С развитием изучения органической химии среди большой группы углеводородов был выделен отдельный класс – «алкины». Данные соединения принято называть ненасыщенными углеводородами, которые содержат в своей структуре одну или несколько тройных (другие названия – тройные углерод‒углеродные или ацетиленовые) связей, что отличает их от алкенов (соединений с двойными связями).
В различных источниках можно встретить и рациональное общее название алкинов – ацетиленовые углеводороды, а такое же название их «остатков» – ацетиленовые радикалы. Ниже в таблице алкины представлены со своей структурной формулой и различными наименованиями.
| Структурные формулы | Номенклатура | |
| Международная ИЮПАК | Рациональная | |
| HC ≡ CH | этин, ацетилен | ацетилен |
| H3C ‒ C ≡ CH | пропин | метилацетилен |
| H3C ‒ CH2 ‒ C≡CH | бутин-1 | этилацетилен |
| H3C ‒ C≡C ‒ CH3 | бутин-2 | диметилацетилен |
| H3C ‒ CH2 ‒ CH2 ‒ C ≡ CH | пентин-1 | пропилацетилен |
| H3C ‒ CH2 ‒ C ≡ C - CH3 | пентин-2 | метилэтилацетилен |
Международная и рациональная номенклатура
Алкинам в химии, согласно номенклатуре ИЮПАК (транслитерация с англ. Международный союз теоретической и прикладной химии), дают названия путем изменения суффикса "-ан" на суффикс "-ин" в названии родственного алкана, например этан → этин (пример 1).
Но можно применять и рациональные названия, например: этин → ацетилен, пропин → метилацетилен (пример 2), то есть присоединять название радикала, находящегося возле тройной связи к наименованию меньшего представителя гомологического ряда.
Следует помнить, что при определении названия сложных веществ, где есть и двойные, и тройные связи, нумерация должна быть такой, чтобы им достались наименьшие цифры. Если есть выбор между началом нумерации, то начинают с двойных связей, например: пентен-1, -ин-4 (пример 3).
Частным случаем данного правила является равноудаленные от конца цепи двойная и тройная связи, как, например, в молекуле гексадиена-1,3, -ин-5 (пример 4). Здесь следует помнить, что нумерация цепи будет начинаться именно с двойной связи.
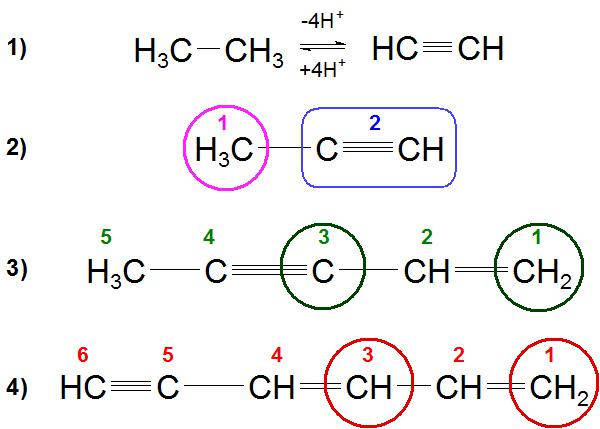
Для алкинов с длинной цепью звеньев (более С5-С6) рекомендуется пользоваться международной номенклатурой ИЮПАК.
Строение молекулы при тройной связи
Наиболее часто встречаемый пример строения молекулы ацетиленового углеводорода представлен для этина, структуру которого можно посмотреть в таблице алкинов. Для простоты понимания ниже будет приведен подробный рисунок взаимодействия углеродных атомов в молекуле ацетилена.
Общая формула алкина - C2H2. Следовательно, в процессе создания тройной связи участвуют 2 атома углерода. Так как углерод четырехвалентен ‒ возбужденное состояние атома ‒ в органических соединениях, на внешней орбитали находится 4 неспаренных электрона – 2s и 2p3 (рис. 1a). В процессе создания связи из электронных облаков s- и одной p-орбитали образуется гибридное облако, которое так и называется sp-гибридное облако (рис. 1б). Гибридные облака в обоих атомах углерода сильно ориентированы по одной оси, что обуславливает их линейное расположение (под углом 180°) относительно друг друга меньшими частями наружу (рис.2). Электроны в бо́льших частях облака при соединении образуют электронную пару и создают σ-связь (сигма-связь, рис. 1в) .
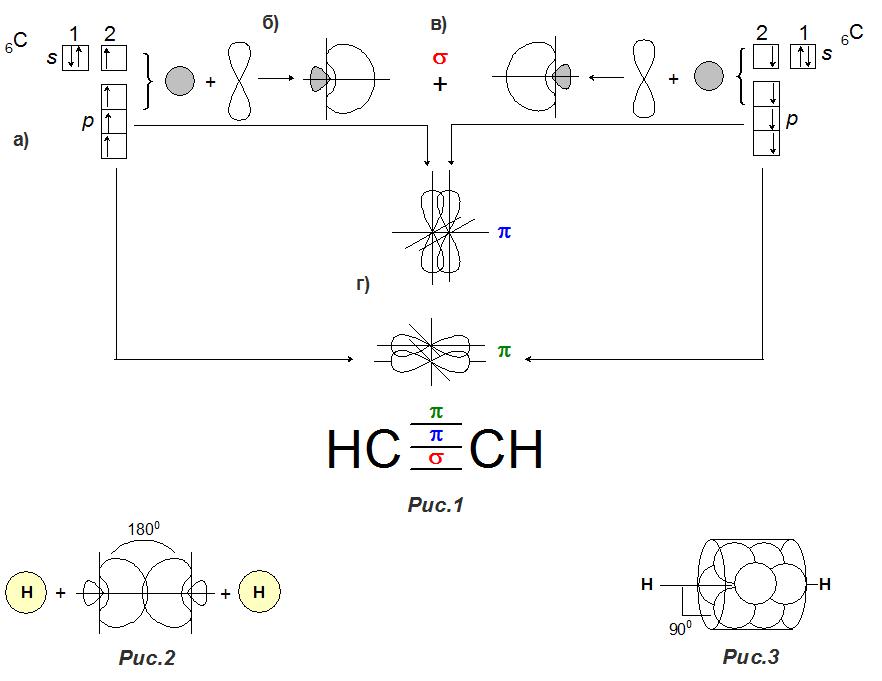
Неспаренный электрон, находящийся в меньшей части, присоединяет такой же электрон атома водорода (рис. 2). Оставшиеся 2 неспаренных электрона на внешней p-орбитали у одного атома взаимодействуют с 2 другими такими же электронами второго атома. При этом каждая пара из двух p-орбиталей перекрывается по принципу π-связи (пи-связи, рис. 1г) и становится ориентирована относительно другой под углом 90°. После всех взаимодействий общее облако принимает цилиндрическую форму (рис. 3).
Физические свойства алкинов
Ацетиленовые углеводороды очень близки по своей природе к алканам и алкенам. В природе они практически не встречаются, кроме этина, поэтому их получают искусственным путем. Низшие алкины (до C17) являются бесцветными газами и жидкостями. Это малополярные вещества, вследствие чего они плохо растворяются в воде и других полярных растворителях. Однако хорошо растворяются в простых органических веществах, таких как эфир, лигроин или бензол, и с повышением давления при сжатии газа данная способность улучшается. Высшие представители данного класса (C17 и выше) являются кристаллическими веществами.
Подробнее о свойствах ацетилена
Так как ацетилен является самым используемым и широко применяемым, физические свойства алкина хорошо изучены. Он представляет собой бесцветный газ при абсолютной химической чистоте без запаха. Технический этин обладает резким запахом из-за присутствия примесей аммиака NH3, сероводорода H2S и фтороводорода HF. Этот сжиженный или газообразный газ очень взрывоопасен и легко воспламеняется даже от статического разряда пальцев. Также, благодаря своим физическим свойствам, алкин в смеси с кислородом дает температуру горения в 3150 °С, что позволяет использовать ацетилен в качестве хорошего горючего газа при сварке и резке металлов. Ацетилен ядовит, поэтому при работе с данным газом нужно соблюдать предельную осторожность.

Лучше всего ацетилен растворяется в ацетоне, особенно в сжиженном состоянии, поэтому при хранении в жидком состоянии используются специальные баллоны, наполненные пористой массой с равномерно распределенным ацетоном под давлением до 25 МПа.

А при использовании в газообразном состоянии газ пускают по специальным трубопроводам, руководствуясь нормативно-технической документацией и ГОСТ 5457-75 «Ацетилен растворенный и газообразный технический. Технические условия», где описана формула алкина и все процедуры по проверке и хранению вышеуказанного газообразного и жидкого углеводорода.
Получение ацетилена
Одним из способов является частичное термическое окисление метана CH4 кислородом при температуре 1500 °С. Данный процесс также называется термоокислительным крекингом. Практически аналогичный процесс происходит при окислении метана на электрической дуге при температуре выше 1500 °С с быстрым охлаждением выделяющихся газов, так как из-за физических свойств алкина ацетилен в смеси с непрореагировавшим метаном может спровоцировать взрыв. Также данный продукт можно получить путем взаимодействия карбида кальция CaC2 и воды при 2000 °С.
Применение
Среди гомологов, как было описано выше, крупномасштабное и постоянное применение получил только ацетилен, причем исторически сложилось, что в производстве используют именно рациональное название.

За счет своих физических и химических свойств и относительно дешевого способа получения этот углеводород используется в производстве различных органических растворителей, синтетических каучуков и полимеров.



























