Теллур – редкий химический элемент с атомным номером 52, принадлежащий наряду с кислородом, серой, селеном и полонием к 16-й группе периодической системы, или, согласно старой классификации, к VI группе (где входит в главную подгруппу) таблицы Менделеева. Являясь аналогом серы и селена, теллур образует соединения, структурно близкие аналогичным сернистым и селенистым оксидам, кислотам, солям. В числе таких соединений значится и теллуровая кислота, свойства которой рассмотрены в данной статье.
Состав и структура
Кислота образуется из теллура, проявляющего высшую степень окисления (+6). Формула теллуровой кислоты: H6TeO6, или H2TeO4*2H2O. По массе кислота содержит: теллура 55,6 %, кислорода 41,8 % и водорода – 2,6 %. Соединение H2TeO4 – так называемая метателлуровая или простая двухосновная кислота, соли которой хорошо известны. В водном растворе постепенно превращается в шестиосновную ортокислоту H6TeO6.
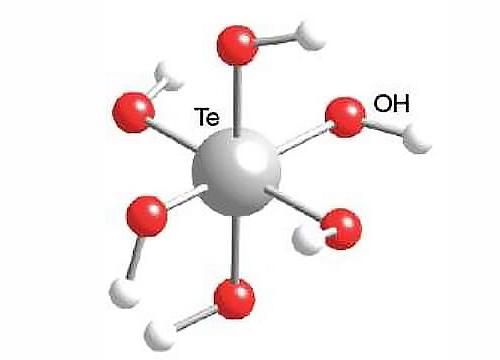
Пространственно и структурно молекула представляет собой октаэдр, все шесть вершин которого образованы OH-группами, а в центре расположен атом теллура, поэтому ее рациональная формула, отражающая строение молекулы, выглядит следующим образом: H6O6Te. Также можно записать формулу в виде Te(OH)6 – это тоже будет правильно.
Физические и химические свойства теллуровой кислоты
Молекулярная масса кислоты составляет 229,642 атомных единиц массы. Плотность этого соединения достигает 3,07 г/см3. При обычных условиях это довольно тяжелое белое порошкообразное вещество с кристаллической структурой. Оно достаточно хорошо растворяется в горячей воде. Плавление происходит при 136 °C. При нагревании в диапазоне температур от 300 °C до 500 °C кислота разлагается на воду и чрезвычайно малорастворимый ангидрид – желтый порошок оксида теллура (VI) альфа-TeO3.
Является ли теллуровая кислота сильной? Нет, это очень слабая кислота, не похожая по свойствам на свои аналоги – серную и селеновую, и слабый окислитель.
Атомы металлов могут замещать в молекуле кислоты водород полностью или частично. Соли – теллураты (иногда употребляется термин «ортотеллураты») – как правило, не растворяются в воде, за исключением теллуратов аммония и металлов щелочной группы, а также солей серебра Ag6TeO6 и ртути Hg3TeO6. Примером неполного замещения водорода металлом может служить натриевая соль Na2H4TeO6.
Все соединения теллура являются сильно токсичными веществами (хотя и не такими опасными, как соединения селена) и вредны для здоровья, поэтому работа с ними требует строгого соблюдения правил техники безопасности.

Получение кислоты
Теллуровую кислоту можно получать несколькими способами:
- Из чистого теллура или теллуристой кислоты H2TeO3 путем окисления азотной и хромовой кислотами с дальнейшим растворением в воде. Затем проводят осаждение кристаллов. Обычно для этих целей пользуются азотной кислотой.
- Окислением кристаллического теллура водным раствором хлорноватой кислоты.
- Окислением диоксида теллура TeO2 перекисью водорода в аммиачной среде и последующим воздействием концентрированной азотной кислоты на теллурат аммония.
- В ходе реакции теллура, берущегося в данном случае в аморфной форме, с перекисью водорода высокой концентрации на водяной бане. После охлаждения теллуровая кислота выпадает из раствора в виде бесцветных кристаллов.
- Из двуокиси теллура, окисляя ее перманганатом калия в присутствии азотной кислоты.
- Из суспензии диоксида теллура. Для окисления реагента берут пероксид водорода. Реакция должна протекать в среде двууглекислого или углекислого натрия либо калия. Затем получившуюся соль обрабатывают на катионите КУ-2. Эти методом добиваются получения кислоты с выходом 93 %.

Сферы применения
Используют эту кислоту для получения некоторых солей. Кроме того, она нередко применяется в химических методах очистки технического теллура путем перекристаллизации полученной из него кислоты. Этот метод отличается тем, что для удаления хромовых, селеновых или калиевых загрязнений нужны дополнительные перекристаллизации. Тем не менее, он является очень эффективным, поскольку дает высокий выход чистого теллура, необходимого в производстве полупроводников, некоторых сплавов, специальных стекол и других высокотехнологичных материалов.
Теллуровая кислота главным образом представляет важность как один из продуктов для лабораторного анализа, как и большинство неорганических реактивов. Для этих целей производится кислота чистотой не менее 99 %. Так что наибольшее применение это соединение находит в лабораторной практике.



























