Химические реакции происходят повсюду вокруг нас. Но что заставляет атомы и молекулы взаимодействовать друг с другом? Чтобы понять это, давайте разберемся с таким фундаментальным понятием химической кинетики, как энергия активации.
Определение энергии активации
Энергия активации - это минимальное количество энергии, которое необходимо сообщить реагирующим веществам, чтобы реакция пошла. Чтобы произошла химическая реакция, молекулы должны столкнуться друг с другом и иметь определенный запас кинетической энергии. Этот необходимый минимум и есть энергия активации.

Наглядно энергию активации можно представить как высоту энергетического барьера, который реагирующие частицы должны преодолеть:
- До соударения молекулы находятся на некотором энергетическом уровне E1
- В момент соударения они получают дополнительную энергию за счет теплового движения
- Если высота барьера Еа меньше, чем суммарная энергия E1 + Едоп, то реакция идет
- Если нет - молекулы просто разлетаются после удара, не вступив в реакцию
Энергия активации измеряется в джоулях на моль или килоджоулях на моль (кДж/моль). Для типичных органических реакций она лежит в диапазоне от 50 до 250 кДж/моль.
Роль энергии активации в кинетике реакций
Как именно энергия активации влияет на скорость химической реакции? Эта зависимость выражается уравнением Аррениуса:
k = A·e-Ea/RT
Где:
- k - константа скорости реакции
- A - предэкспоненциальный множитель
- Ea - энергия активации, Дж/моль
- R - универсальная газовая постоянная, 8,314 Дж/(моль·К)
- T - температура, К
Из этого уравнения видно, что с повышением Ea скорость реакции падает по экспоненте. А с ростом температуры кинетика ускоряется, так как больше молекул преодолевают энергетический барьер.
Для прикидочных расчетов существует еще правило:
При повышении температуры на 10°С скорость реакции возрастает в 2-4 раза.
Это правило отражает тот факт, что в обычных условиях подавляющее большинство молекул не обладает достаточной энергией для преодоления активационного барьера Еа. Небольшое увеличение температуры резко увеличивает долю "горячих" молекул, способных вступить в реакцию.
Переходное состояние
В момент химической реакции система проходит через так называемое переходное состояние. Это кратковременное высокоэнергетическое состояние, в котором разрываются старые химические связи и образуются новые.
Именно энергия этого нестабильного переходного состояния и есть энергия активации Ea. Преодолев "горб" на диаграмме, система переходит в более стабильное состояние с образованием продуктов реакции.
Методы определения энергии активации
Существует несколько способов экспериментально определить энергию активации:
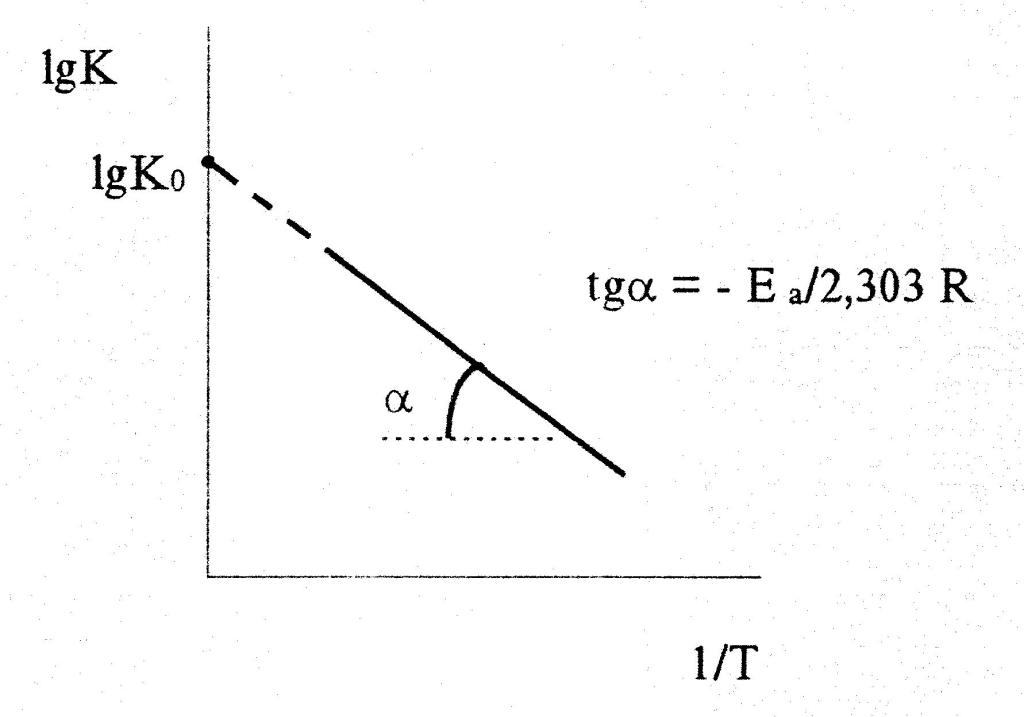
- Измерить кинетику реакции при разных температурах и построить график зависимости ln k от 1/T.
- Сравнить скорости реакции с похожими соединениями, у которых известна Ea.
- Оценить тепловой эффект реакции и вычислить Ea по разности энергий реагентов и продуктов.
Первый метод считается наиболее точным, но требует значительных временных затрат.
Зависимость Ea от природы реагентов
Величина энергии активации во многом зависит от природы участников реакции. Можно выделить несколько факторов:
- Агрегатное состояние веществ (газообразные реагируют быстрее)
- Тип химической связи (ионная > ковалентная)
- Заряд и размер молекул
- Наличие катализатора
Например, для реакций горения водорода энергия активации составляет всего 60-80 кДж/моль. А для полимеризации этилена достигает 250 кДж/моль.
Реакции с высокой и низкой Ea
Существуют реакции с аномально высокими или низкими значениями Ea. К первым относятся:
- Радикальная полимеризация алкенов
- Пиролиз углеводородов
- Некаталитическое окисление органики
Ко вторым - обычно реакции с участием свободных радикалов, ионов или атомов:
- Горение водорода
- Галогенирование алканов
- Реакции в плазме
Роль катализаторов
Одним из ключевых факторов, влияющих на энергию активации, являются катализаторы. Их действие основано на том, что они предоставляют альтернативный путь протекания реакции через промежуточные каталитические комплексы.
Катализаторы работают за счет снижения энергии активации, необходимой для реакции, но сами при этом не расходуются.
Различают следующие типы катализаторов:
- Гомогенные
- Гетерогенные
- Биологические (ферменты)
- Фотокатализаторы
Механизм действия
Все катализаторы в основном действуют по одному механизму:
- Образование промежуточных активных комплексов с участием катализатора
- Более быстрое превращение комплексов в продукты
- Регенерация катализатора
За счет многократного повторения этого цикла достигается высокая скорость каталитических реакций.
Применение катализаторов
Главная область использования катализаторов - химическая промышленность. Катализ позволяет:
- Повысить выход целевых продуктов
- Снизить энергозатраты
- Уменьшить нагрузку на окружающую среду
Ярким примером служит процесс получения аммиака по методу Габера-Боша.
Роль катализаторов
Одним из ключевых факторов, влияющих на энергию активации, являются катализаторы. Их действие основано на том, что они предоставляют альтернативный путь протекания реакции через промежуточные каталитические комплексы.
Катализаторы работают за счет снижения энергии активации, необходимой для реакции, но сами при этом не расходуются.
Все катализаторы в основном действуют по одному механизму:
- Образование промежуточных активных комплексов с участием катализатора
- Более быстрое превращение комплексов в продукты
- Регенерация катализатора
За счет многократного повторения этого цикла достигается высокая скорость каталитических реакций.
Роль катализаторов
Одним из ключевых факторов, влияющих на энергию активации, являются катализаторы. Их действие основано на том, что они предоставляют альтернативный путь протекания реакции через промежуточные каталитические комплексы.
Катализаторы работают за счет снижения энергии активации, необходимой для реакции, но сами при этом не расходуются.
Механизм действия
Все катализаторы в основном действуют по одному механизму:
- Образование промежуточных активных комплексов с участием катализатора
- Более быстрое превращение комплексов в продукты
- Регенерация катализатора
За счет многократного повторения этого цикла достигается высокая скорость каталитических реакций.
























