Как определить валентность химических элементов в соединении по его формуле и зачем это нужно
Валентность - фундаментальное понятие в химии, позволяющее определять состав веществ и предсказывать возможность их образования. Без знания валентности элементов невозможно составление формул химических соединений, расчеты при химических реакциях, понимание строения молекул.
В данной статье подробно разбираются вопросы: что такое валентность, какие бывают элементы по валентности, как определить валентность по формуле соединения. Приводятся разнообразные примеры и способы нахождения валентности.
Понятие валентности в химии
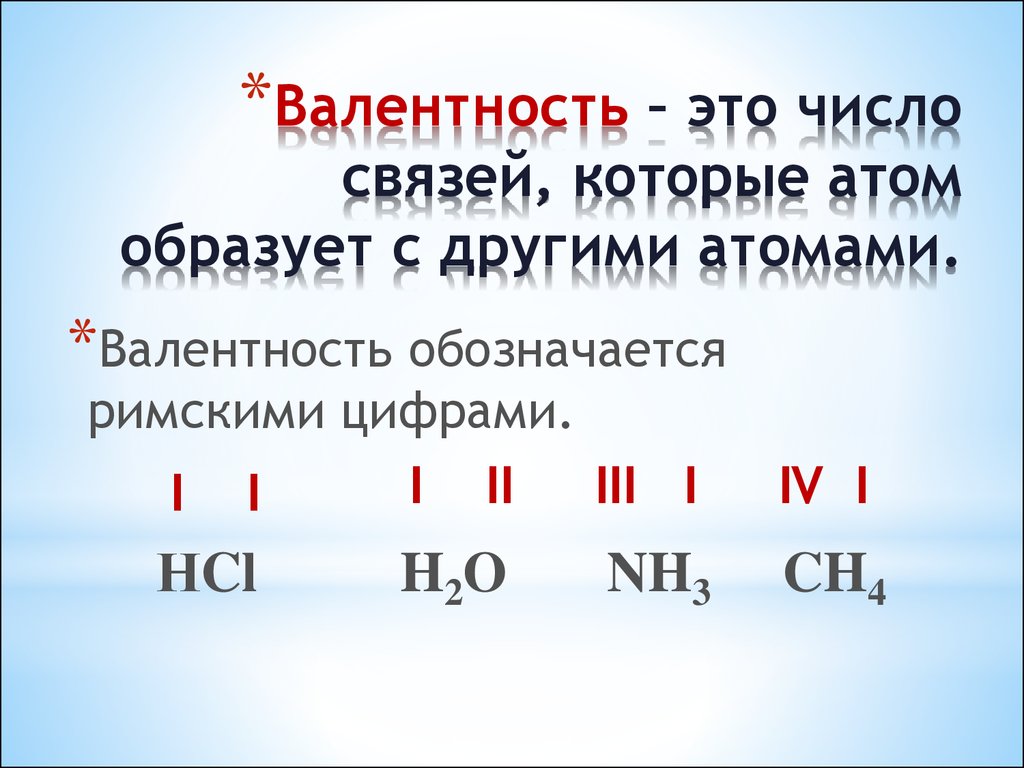
Валентность – это способность атома образовывать химические связи с другими атомами. Такие связи создаются за счет электронов, расположенных на внешнем электронном слое. Поэтому «формула валентности» является количественной мерой числа совместных связей между атомами.
Существуют разные способы «как определить валентность по формуле» химических элементов. Самый простой заключается в том, чтобы обратиться к специальной таблице валентности химических элементов. Другой способ связан с расчетом валентности по химической формуле.
- За единицу валентности принимается валентность атома водорода, так как он способен образовывать с другими атомами только одну связь.
- Химические элементы, взаимодействуя с водородом, показывают собственную валентность.
Элементы с постоянной и переменной валентностью
Среди всех химических элементов выделяют две группы - с постоянной и переменной валентностью. У элементов с постоянной валентностью она одинакова в любом соединении. К таким элементам относятся водород, кислород, фтор, хлор, бром, йод. Их валентность нужно запомнить:
- водород - I
- кислород - II
- фтор - I
- хлор - I
- бром - I
- йод - I
Элементов с переменной валентностью большинство. Она меняется в зависимости от соединения. Для них характерны высшая, промежуточная и низшая валентности:
- Высшая валентность для элементов главных подгрупп совпадает с номером группы.
- Низшая валентность вычисляется по формуле: 8 - номер группы.
- Промежуточная валентность - число между низшей и высшей валентностью. Обычно соответствует четности группы.
Например, сера расположена в группе VIA, значит ее валентности:
- высшая - VI
- низшая - 8 - 6 = II
- промежуточная - IV (четное число между II и VI)
При «формула валентности» по формуле соединения валентность необходимо рассчитать.
Как найти валентность по формуле химического соединения
Чтобы определить валентность химического элемента в соединении, нужно воспользоваться его формулой. Существует несколько способов это сделать:
- Если в формуле присутствует водород или кислород, то их валентность известна - соответственно I и II. По количеству атомов H или O, связанных с данным элементом, можно определить его валентность.
- Если известна валентность одного из элементов в бинарном соединении (состоящем из двух элементов), то валентность второго находится по правилу: сумма валентностей элементов в формуле должна быть равна нулю.
- В сложных соединениях валентность находится методом подбора - подставляют различные значения валентности, пока сумма валентностей в формуле не станет равна нулю.
Рассмотрим несколько примеров определения валентности элемента по формуле:
- В соединении H2S валентность S равна II, так как сера связана с двумя атомами водорода.
- В оксиде SO2 валентность серы IV, поскольку кислород двухвалентен, а IV · 2 = VIII.
- В CaO валентность Ca = II, т.к. O - II, сумма валентностей = 0.
- В HNO3 валентность N = V, так как 3 атома O имеют суммарную валентность 3 · II = VI, чтобы сумма была нулевой, валентность N должна быть V.
При использовании формулы для нахождения валентности элемента нужно помнить следующие правила:
- В бинарных соединениях неметаллы, стоящие на втором месте, проявляют низшую валентность.
- Металлы в соединениях с неметаллами проявляют положительные валентности.
- Отрицательные валентности характерны для неметаллов в соединениях друг с другом и в комплексных соединениях.
Таким образом, определить валентность по формуле - это простая операция, если знать основные закономерности и владеть несколькими способами расчета.
Применение знаний о валентности на практике
Знания о валентности элементов широко применяются на практике для:
- Составления формул химических соединений по валентностям элементов.
- Определения состава вещества по его формуле.
- Объяснения химического строения веществ.
- Прогнозирования свойств неизвестных соединений.
- Расчета относительных молекулярных масс.
Рассмотрим подробнее, как используются знания о валентности для составления формул соединений. Для этого нужно:
- Записать символы элементов.
- Указать валентность каждого элемента над его символом римской цифрой.
- Найти наименьшее общее кратное (НОК) валентностей всех элементов.
- Разделить НОК на валентность каждого элемента.
- Записать полученные индексы справа внизу от символов элементов.
Например, составим формулу оксида азота(III):
- Элементы: N и O.
- Валентности: NIII и OII.
- НОК валентностей = 6.
- Делим 6 на III и II:
- 6:III = 2 (индекс азота)
- 6:II = 3 (индекс кислорода)
- Записываем формулу: N2O3.
Таким образом, используя валентность, можно не только найти состав неизвестного вещества, но и предсказать, какие соединения могут образоваться из определенных элементов. Это очень важно для понимания химических процессов и свойств веществ. Поэтому умение определять валентность по формуле является фундаментальным навыком для изучения химии.