В химической кинетике одной из важных задач является нахождение порядка реакции. Хоть эта величина и формальная, но позволяет наилучшим образом отразить экспериментальную зависимость скорости какой-либо реакции от концентрации. Как правило, для нахождения скорости реакции используют концентрации исходных соединений, взятых в степенях, соответствующих их стехиометрическим коэффициентам. Но это справедливо лишь для очень простых реакций.
Порядком химической реакции по веществу является значение степени n, в которой концентрация этого соединения входит в формулу для нахождения скорости реакции, полученную опытным путем. А вот общий порядок составляет сумму всех порядков по веществам: n = n1 + n2. Значения n1 и n2 соответствуют стехиометрическим коэффициентам в уравнениях одностадийных реакций. Фактически, они могут иметь положительные или отрицательные значения, быть целыми или дробными числами.
Например, для уравнения взаимодействия H2+ Ι2 ― > 2HΙ, которому соответствует формула для определения скорости v=kCHCI, порядки по веществам равны nH=1 и nI=1, общий порядок реакции n=nH+nI=1+1=2.
Нулевой порядок
Некоторые реакции имеют нулевой порядок реакции. Как правило, на них не влияют концентрации исходных соединений. Происходит это в следующих случаях:
- если какое-либо исходное вещество взято в существенном избытке;
- если скорость регулируется энергией активации молекул, участвующих в реакции, например, в фотосинтезе.
В качестве примера рассмотрим реакцию взаимодействия этилуксусного эфира с водой, т.е. его омыления.
СΗ3СООС2Η5 + Η2О ―> СΗ3СООΗ + С2Η5ОΗ
Поскольку взаимная растворимость исходных веществ крайне мала, то основная их масса находится в разных фазах. При расходовании эфира в химической реакции из эфирного слоя своевременно поступает новая его порция, то есть концентрация его в растворе не уменьшается.
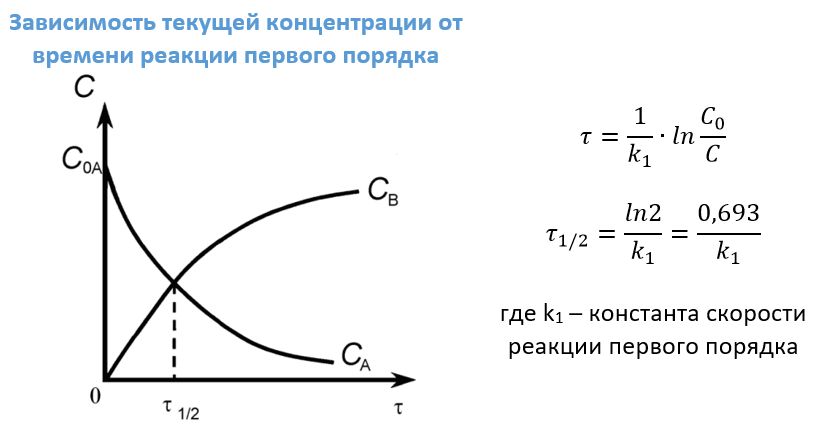
Реакции первого порядка
Такое взаимодействие веществ можно условно записать уравнением: А―>В. Примером может послужить разложение диметилового эфира:
СΗ3ОСΗ3―>СΗ4+Η2+СО
Для которого скорость реакции определяется как v=kCС2Н6О. В данном случае порядок по веществу и общий порядок совпадают и равны единице.
Практическое значение для реакций первого порядка имеет время (τ) определения некой заданной концентрации С, если известна начальная концентрация Со, а также период полураспада τ1/2, это время, в течение которого успевает прореагировать половина исходного вещества.
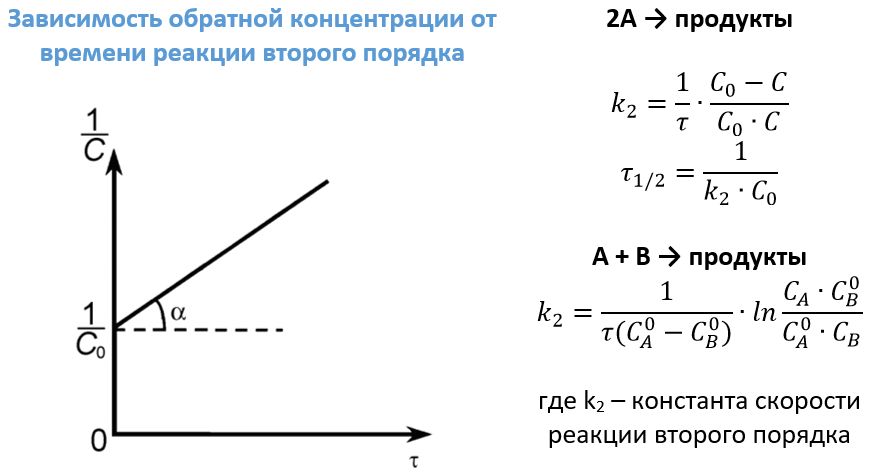
Реакции второго порядка
К таким взаимодействиям можно отнести реакции типа А + В ―> продукты. Примером может послужить уже приводимая выше реакция получения йодоводорода или щелочное омыление этилацетата:
СΗ3СООС2H5 + ОΗ- ―> СН3СОО- + С2H5ОΗ, v=kCС4Н8О2СОН-.
Также (к) второй порядок имеют отдельные реакции разложения типа: 2А ―> продукты. В качестве примеров можно привести следующие:
- 2NOCl ―> 2NO + Cl2, v=kC2NOCl.
- 2О3 ―> 3O2, v=kC2О3.
- 2NO2 ―> 2NO + O2, v=kC2NO2.
Последующие реакции
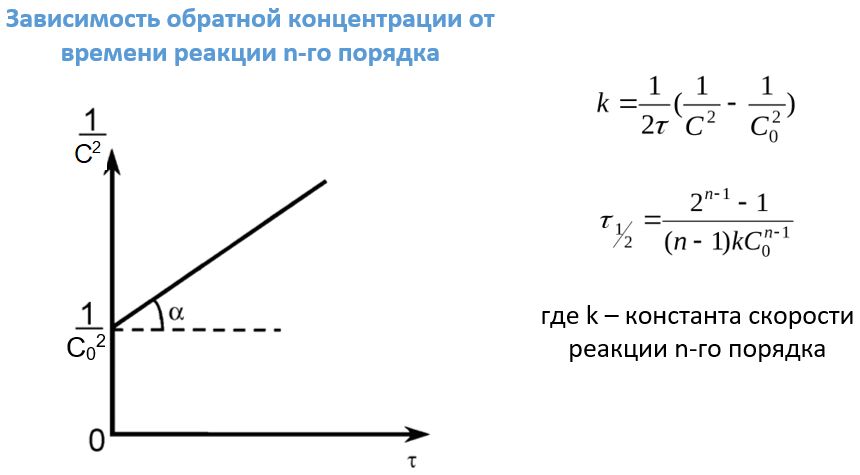
Реакции третьего и последующего порядков встречаются реже, чем предыдущие варианты. Это объясняется низкой вероятностью одновременной встречи в пространстве трех и более частиц. Тем не менее, примером таких взаимодействий может послужить образование диоксидов азота и углерода из их монооксидов:
- 2NΟ+Ο2→ 2NΟ2, v=kC2NOСО2.
- 2СО+О2→ 2СО2, v=kC2СОСО2.
Для таких реакций также существует своя зависимость концентраций реагентов от времени ее протекания. Формулы для нахождения периода полупревращения и констант скоростей реакций унифицированы за счет введения индекса n, равного порядку этих самых реакций.
Молекулярность реакции
Не нужно путать порядок реакции с ее молекулярностью, которая определяется именно числом молекул, которые совершают акт химического превращения. В отличие от порядка, который определяется экспериментально, молекулярность химической реакции имеет теоретическую основу. Для ее определения нужно понимать суть процесса, как именно взаимодействуют молекулы между собой, через какие стадии превращения они проходят.
| Порядок | Молекулярность |
| Формальная величина | Есть физический смысл, показывает число реагирующих молекул |
| Может принимать различные числовые значения | Принимает только одно из трех значений: 1,2,3 |
| Применяется к реакциям любой сложности и многостадийности | Применяется только к элементарным одностадийным реакциям |
Существует несколько причин, по которым не совпадает для одной и той же реакции порядок и молекулярность:
- если один из реагентов взят в большом избытке, о чем уже говорилось выше;
- для многих гетерогенных реакций порядок может изменяться в ходе их осуществления, особенно если при этом меняются условия их протекания;
- каталитические реакции имеют многостадийный механизм, суть которого не всегда отражается стехиометрическим уравнением;
- в сложных многостадийных реакциях на суммарное значение скорости может повлиять только одна из промежуточных, которая в результате и будет определять порядок всего превращения.
К мономолекулярным относят реакции распада молекул:
I2 ―> 2I
В бимолекулярных реакциях сталкиваются две молекулы. Причем это могут быть молекулы как разных веществ, так и одного и того же:
H2+ Ι2 ―> 2HΙ
Тримолекулярными называют такие реакции, для осуществления которых нужны три молекулы исходных веществ:
2NΟ + H2 ―> N2Ο + H2О
H2 + О2 ―> 2H2О