В химии и физике атомные орбитали – это функция, называемая волновой, которая описывает свойства, характерные для не более двух электронов в окрестностях атомного ядра или системы ядер, как в молекуле. Орбиталь часто изображается как трехмерная область, внутри которой существует 95-процентная вероятность нахождения электрона.
Орбитали и орбиты
Когда планета движется вокруг Солнца, она очерчивает путь, называемый орбитой. Подобным образом атом можно представить в виде электронов, кружащих на орбитах вокруг ядра. На самом деле все обстоит иначе, и электроны находятся в областях пространства, известных как атомные орбитали. Химия довольствуется упрощенной моделью атома для расчета волнового уравнения Шредингера и, соответственно, определения возможных состояний электрона.
Орбиты и орбитали звучат похоже, но они имеют совершенно разные значения. Крайне важно понимать разницу между ними.

Невозможность изображения орбит
Чтобы построить траекторию движения чего-то, нужно точно знать, где объект находится, и быть в состоянии установить, где он будет через мгновение. Для электрона это сделать невозможно.
Согласно принципу неопределенности Гейзенберга, нельзя точно знать, где частица находится в данный момент и где она окажется потом. (На самом деле принцип говорит о том, что невозможно определить одновременно и с абсолютной точностью ее момент и импульс).
Поэтому невозможно построить орбиту движения электрона вокруг ядра. Является ли это большой проблемой? Нет. Если что-то невозможно, это следует принять и найти способы обойти.
Электрон водорода – 1s-орбиталь
Предположим, имеется один атом водорода и в определенный момент времени графически запечатлевается положение одного электрона. Вскоре после этого, процедура повторяется, и наблюдатель обнаруживает, что частица находится в новом положении. Как она из первого места попала во второе, неизвестно.
Если продолжать действовать таким образом, то постепенно сформируется своего рода 3D-карта мест вероятного нахождения частицы.
В случае атома водорода электрон может находиться в любом месте в пределах сферического пространства, окружающего ядро. На диаграмме показано поперечное сечение этого сферического пространства.
95 % времени (или любой другой процент, так как стопроцентную уверенность могут обеспечить лишь размеры Вселенной) электрон будет находиться в пределах довольно легко определяемой области пространства, достаточно близкой к ядру. Такой участок называется орбиталью. Атомные орбитали – это области пространства, в которых существует электрон.
Что он там делает? Мы не знаем, не можем знать и поэтому просто игнорируем эту проблему! Мы можем сказать лишь, что если электрон находится на конкретной орбитали, то он будет обладать определенной энергией.
Каждая орбиталь имеет название.
Пространство, занимаемое электроном водорода, называется 1s-орбиталью. Единица здесь обозначает то, что частица находится на ближайшем к ядру энергетическом уровне. S говорит о форме орбиты. S-орбитали сферически симметричны относительно ядра – по крайней мере, как полый шар из довольно плотного материала с ядром в его центре.
2s
Следующая орбиталь – 2s. Она похожа на 1s, за исключением того, что область наиболее вероятного нахождения электрона расположена дальше от ядра. Это орбиталь второго энергетического уровня.
Если присмотреться внимательно, то можно заметить, что ближе к ядру есть еще один регион несколько более высокой плотности электрона («плотность» является еще одним способом обозначения вероятности того, что эта частица присутствует в определенном месте).
2s-электроны (и 3s, 4s и т. д.) проводят часть своего времени намного ближе к центру атома, чем можно было бы ожидать. Результатом этого является небольшое снижение их энергии на s-орбиталях. Чем ближе электроны приближаются к ядру, тем меньше становится их энергия.
3s-, 4s-орбитали (и т. д.) располагаются все дальше от центра атома.
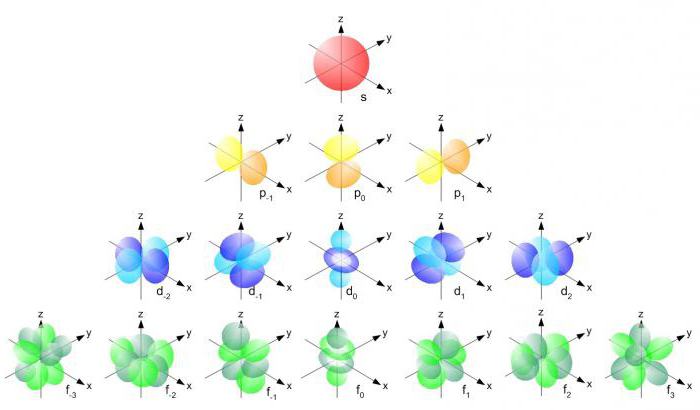
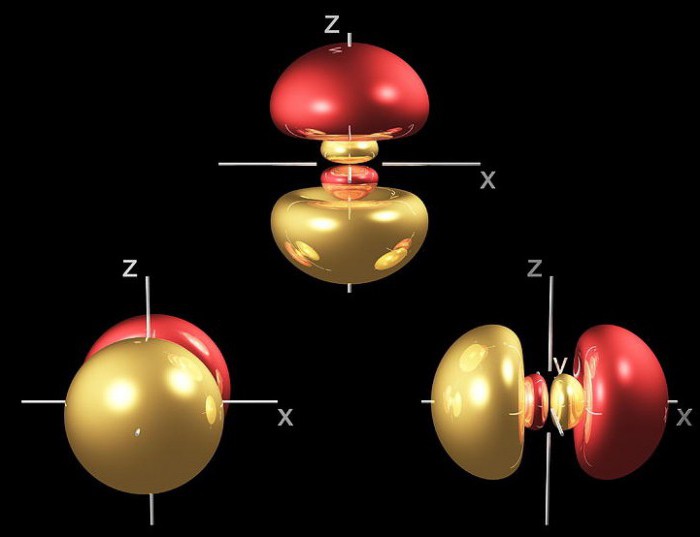
Р-орбитали
Не все электроны населяют s-орбитали (на самом деле, очень немногие из них там находятся). На первом энергетическом уровне единственным доступным местом расположения для них является 1s, на втором добавляются 2s и 2p.
Орбитали этого типа скорее походят на 2 одинаковых воздушных шара, связаны друг с другом на ядре. На диаграмме показано поперечное сечение 3-мерной области пространства. Опять же, орбиталь показывает лишь область с 95-процентной вероятностью нахождения отдельного электрона.
Если представить себе горизонтальную плоскость, которая проходит через ядро таким образом, что одна частью орбиты будет находиться над плоскостью, а другая под ней, то существует нулевая вероятность нахождения электрона на этой плоскости. Так как же частица попадает из одной части в другую, если он никогда не сможет пройти через плоскость ядра? Это связано с ее волновой природой.
В отличие от s-, p-орбиталь имеет определенную направленность.
На любом энергетическом уровне можно иметь три абсолютно эквивалентные р-орбитали, расположенные под прямым углом друг к другу. Они произвольно обозначаются символами рх, ру и pz. Так принято для удобства – то, что подразумевается под направлениями X, Y или Z, постоянно изменяется, т. к. атом беспорядочно движется в пространстве.
Р-орбитали на втором энергетическом уровне называются 2рх, 2ру и 2pz. Есть подобные орбитали и на последующих – 3px, 3py, 3pz, 4px, 4py, 4pz и так далее.
Все уровни, за исключением первого, имеют р-орбитали. На более высоких «лепестки» вытянутее, с наиболее вероятным местом нахождения электрона на большем удалении от ядра.
d- и f-орбитали
В дополнение к s- и р-орбиталям, существует два других набора орбиталей, доступных для электронов на более высоких уровнях энергии. На третьем возможно существование пяти d-орбиталей (со сложными формами и именами), а также 3s- и 3p-орбиталей (3px, 3py, 3pz). В общей сложности их здесь имеется 9.
На четвертом, наряду с 4s и 4p и 4d появляются 7 дополнительных f-орбиталей – всего 16, доступных также на всех более высоких энергетических уровнях.
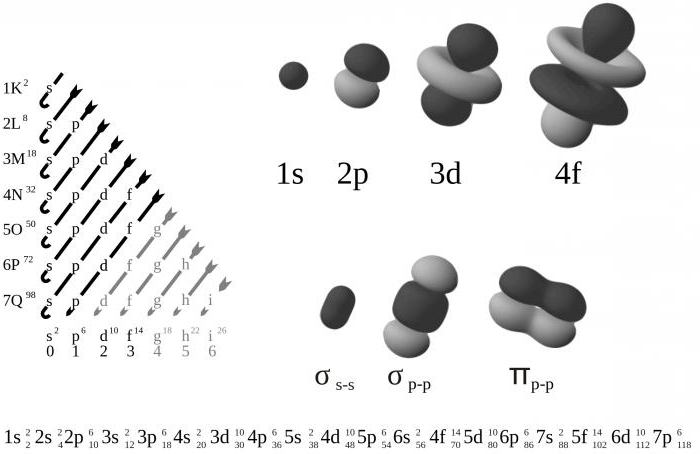
Размещение электронов на орбиталях
Атом можно представить, как очень причудливый дом (подобный перевернутой пирамиде) с ядром, живущим на первом этаже, и различными комнатами на верхних этажах, занимаемых электронами:
- на первом этаже есть только 1 комната (1s);
- на втором комнат уже 4 (2s, 2рх, 2ру и 2pz);
- на третьем этаже расположено 9 комнат (одна 3s, три 3р и пять 3d-орбиталей) и так далее.
Но комнаты не очень большие. Каждая из них может содержать только 2 электрона.
Удобный способ показать атомные орбитали, в которых находятся данные частицы – это нарисовать «квантовые ячейки».
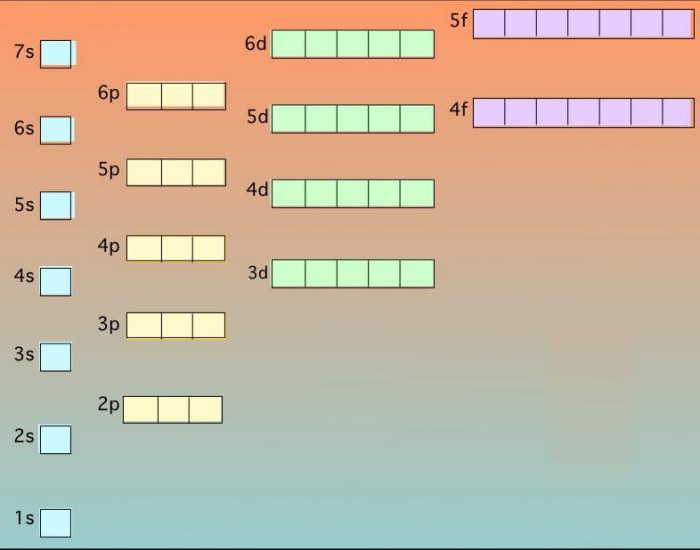
Квантовые ячейки
Атомные орбитали могут быть представлены в виде квадратов с электронами в них, изображенными в виде стрелок. Часто стрелки, направленные вверх и вниз, используются, чтобы показать, что эти частицы отличаются друг от друга.
Необходимость наличия разных электронов в атоме является следствием квантовой теории. Если они находятся на разных орбиталях – это прекрасно, но если они расположились на одной, то между ними должно существовать какой-то тонкое различие. Квантовая теория наделяет частицы свойством, которое носит название «спин» – именно его и обозначает направление стрелок.
1s-орбиталь с двумя электронами изображается в виде квадрата с двумя стрелками, направленными вверх и вниз, но ее также можно записать еще быстрее как 1s2. Это читается как «один s два», а не как «один s в квадрате». Не следует путать числа в этих обозначениях. Первое обозначает энергетический уровень, а второе – количество частиц на орбитали.

Гибридизация
В химии гибридизация является концепцией смешивания атомных орбиталей в новые гибридные, способные спаривать электроны с формированием химических связей. Sp-гибридизация объясняет химические связи таких соединений, как алкины. В этой модели атомные орбитали углерода 2s и 2p смешиваются, образуя две sp-орбитали. Ацетилен C2H2 состоит из sp-sp-переплетения двух атомов углерода с образованием σ-связи и двух дополнительных π-связей.
Атомные орбитали углерода в предельных углеводородах имеют одинаковые гибридные sp3-орбитали, имеющие форму гантели, одна часть которой намного больше другой.
Sp2-гибридизация подобна предыдущим и образована смешением одной s и двух p-орбиталей. Например, в молекуле этилена образуются три sp2- и одна p-орбиталь.
Атомные орбитали: принцип заполнения
Представляя себе переходы от одного атома к другому в периодической таблице химических элементов, можно установить электронную структуру следующего атома путем размещения дополнительной частицы в следующую доступную орбиталь.
Электроны, прежде чем заполнить более высокие энергетические уровни, занимают более низкие, расположенные ближе к ядру. Там, где есть выбор, они заполняют орбитали по отдельности.
Такой порядок заполнения известен под названием правила Хунда. Оно применяется только тогда, когда атомные орбитали обладают равными энергиями, а также помогает минимизировать отталкивание между электронами, что делает атом более стабильным.
Следует обратить внимание на то, что у s-орбитали энергия всегда немного меньше, чем у р на том же энергетическом уровне, поэтому первые всегда заполняются раньше последних.
Что действительно странно, так это положение 3d-орбиталей. Они находятся на более высоком уровне, чем 4s, и поэтому 4s-орбитали заполняются первыми, а затем уже все 3d- и 4p-орбитали.
Такая же путаница происходит и на более высоких уровнях с большим количеством переплетений между ними. Поэтому, например, атомные орбитали 4f не заполняются, пока не будут заняты все места на 6s.
Знание порядка заполнения имеет центральное значение для понимания того, как описывать электронные структуры.


























