Работа нашего организма – чрезвычайно сложный процесс, в котором задействованы миллионы клеток, тысячи самых разнообразных веществ. Но есть одна область, которая целиком и полностью зависит от особых белков, без которых жизнь человека или животного окажется совершенно невозможной. Как вы наверняка догадались, говорим мы сейчас о ферментах.
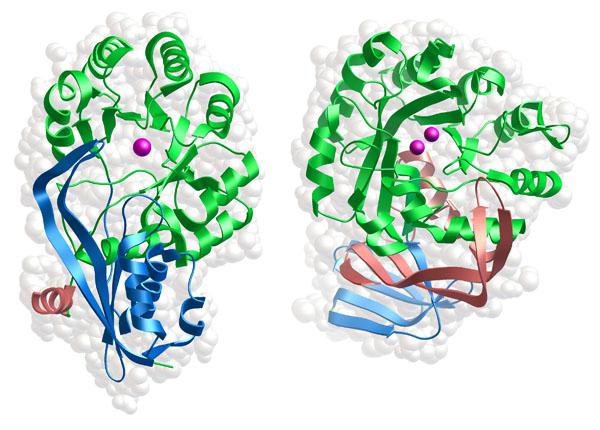
Так как в основе этих веществ лежат преимущественно белки, то они сами могут считаться ими. Нужно знать, что впервые ферменты были открыты еще в 30-е годы 19-го века, вот только ученым понадобилось более века, дабы прийти к более-менее единому определению для них. Так какую функцию выполняют белки-ферменты? Об этом, а также об их строении и примерах реакций вы узнаете из нашей статьи.
Нужно понимать, что далеко не всякий белок может быть ферментом даже теоретически. Только белки глобулярной формы способны проявлять каталитическую активность в отношении других органических соединений. Как и все природные соединения этого класса, ферменты состоят из аминокислотных остатков. Запомните, что ферментативная функция белков (примеры которой будут в статье) может выполняться только теми из них, чья молярная масса не меньше 5000.
Что такое фермент, современные определения
Энзимы – это катализаторы биологического происхождения. Они обладают способностью ускорять реакции за счет теснейшего соприкосновения между двумя участвующими в реакции веществами (субстратами). Можно сказать, что ферментативная функция белков - это процесс катализа некоторых биохимических реакций, которые характерны только для живого организма. Лишь незначительная их часть может быть воспроизведена в условиях лаборатории.
Какие части энзима непосредственно участвуют в реакции?
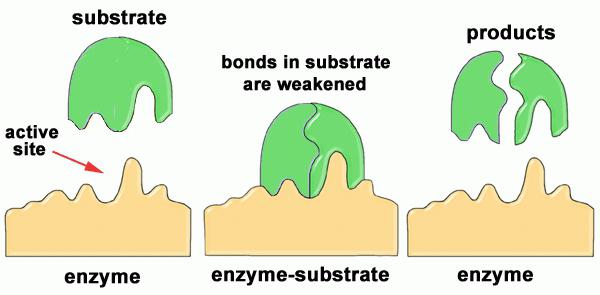
Заметим, что в контакт с субстратом входит не все тело фермента, а лишь его небольшой участок, который называется активным центром. В этом заключается их главное свойство, комплементарность. Это понятие подразумевает, что фермент идеально подходит к субстрату по форме и своим физико-химическим свойствам. Можно сказать, что функция белков-ферментов в этом случае состоит в следующем:
- Их водная оболочка сходит с поверхности.
- Происходит определенная деформация (поляризация, к примеру).
- После чего они особым образом располагаются в пространстве, одновременно сближаясь друг с другом.
Именно эти факторы приводят к ускорению реакции. А сейчас давайте проведем сравнение между энзимами и неорганическими катализаторами.
Сравниваемая характеристика | Ферменты | Неорганические катализаторы |
Ускорение прямой и обратной реакции | Одинаковое | Одинаковое |
Специфичность (комплементарность) | Подходят только к определенному типу веществ, высокая специфичность | Могут быть универсальными, ускоряя сразу несколько схожих реакций |
Скорость реакции | Увеличивают интенсивность реакции в несколько миллионов раз | Ускорение в сотни и тысячи раз |
Реакция на нагревание | Реакция сходит на «нет» из-за полной или частичной денатурации участвующих в ней белков | При нагревании большинство каталитических реакций многократно ускоряются |
Как видите, ферментативная функция белков предполагает специфичность. От себя также добавим, что многие из этих белков обладают еще и видовой специфичностью. Проще говоря, ферменты человека вряд ли подойдут для морской свинки.
Важные сведения о строении ферментов
Что же касается вторичного уровня, то принадлежность к нему определяется при помощи дополнительных типов связей, которые могут возникать между этими аминокислотными остатками. Это связи водородные, электростатические, гидрофобные, а также Ван-дер-Ваальсовы взаимодействия. В результате того напряжения, которое эти связи вызывают, в различных частях фермента образуются α-спирали, петли и β-тяжи.
Третичная структура появляется в результате того, что сравнительно большие участки полипептидной цепи попросту сворачиваются. Образовавшиеся в результате этого тяжи называются доменами. Наконец, окончательное формирование этой структуры происходит только после того, как между различными доменами устанавливается устойчивое взаимодействие. Следует помнить, что образование самих доменов происходит в абсолютно независимом друг от друга порядке.
Некоторые характеристики доменов
Как правило, полипептидная цепь, из которой они образуются, состоит приблизительно из 150 аминокислотных остатков. Когда домены взаимодействуют друг с другом, образуется глобула. Так как ферментативную функцию выполняют активные центры на их основе, следует понимать важность данного процесса.
Сам домен отличается тем, что между аминокислотными остатками в его составе наблюдаются многочисленные взаимодействия. Их число намного больше таковых для реакций между самими доменами. Таким образом, полости между ними сравнительно «уязвимы» для действия различных органических растворителей. Объем их составляет порядка 20-30 кубических ангстрем, которые умещают несколько молекул воды. Разные домены чаще всего имеют совершенно уникальную пространственную структуру, что связано с выполнением ими совершенно различных функций.
Активные центры
Как правило, активные центры располагаются строго между доменами. Соответственно, каждый из них играет весьма важную роль в протекании реакции. Вследствие такого расположения доменов обнаруживается значительная гибкость, подвижность этой области фермента. Это чрезвычайно важно, так как ферментативную функцию выполняют только те соединения, которые могут соответствующим образом изменять свое пространственное положение.
Между длиной полипептидной связи в теле энзима и тем, насколько сложные функции им выполняются, существует прямая связь. Усложнение роли достигается как за счет формирования активного центра реакции между двумя каталитическими домена, так и благодаря образованию совершенно новых доменов.
Некоторые белки-ферменты (примеры - лизоцим и гликогенфосфорилаза) могут очень сильно различаться по своим размерам (129 и 842 аминокислотных остатка соответственно), хоть и катализируют реакцию расщепления одинаковых типов химических связей. Отличие состоит в том, что более массивные и крупные энзимы способны лучше контролировать свое положение в пространстве, чем обеспечивается большая стабильность и скорость реакции.
Основная классификация ферментов
1. Оксидоредуктазы. Функция белков-ферментов в этом случае – стимуляция окислительно-восстановительных реакций.
2. Трансферазы. Могут осуществлять перенос между субстратами следующих групп:
- Одноуглеродные остатки.
- Остатки альдегидов, а также кетонов.
- Ацильные и гликозильные компоненты.
- Алкильные (в виде исключения не могут переносить СН3) остатки.
- Азотистые основания.
- Группы, содержащие фосфор.
3. Гидролазы. В этом случае значение ферментативной функции белков состоит в расщеплении следующих типов соединений:
- Сложных эфиров.
- Гликозидов.
- Эфиров, а также тиоэфиров.
- Связей пептидного типа.
- Связей типа C-N (кроме все тех же пептидов).
4. Лиазы. Обладают способностью к отцеплению групп с последующим образованием двойной связи. Кроме того, могут выполнять и обратный процесс: присоединение отдельных групп к двойным связям.
5. Изомеразы. В данном случае ферментативная функция белков заключается в катализе сложных изомерных реакций. К этой группе относятся следующие энзимы:
- Рацемазы, эпимеразы.
- Цистрансизомеразы.
- Внутримолекулярные оксидоредуктазы.
- Внутримолекулярные трансферазы.
- Внутримолекулярные лиазы.
6. Лигазы (иначе известные как синтетазы). Служат для расщепления АТФ с одновременным образованием некоторых связей.
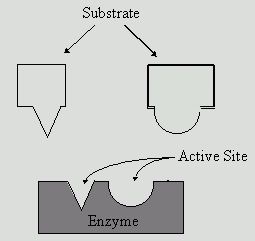
Что остается от фермента после взаимодействия с субстратом?
Нередко ферментом бывает белок глобулярного происхождения, активный центр которого представлен его же аминокислотными остатками. Во всех прочих случаях в состав центра входит прочно связанная с ним простетическая группа или же кофермент (АТФ, к примеру), связь которого намного слабее. Целый катализатор называется холоферментом, а его остаток, образовавшийся после удаления АТФ, апоферментом.
Таким образом, по этому признаку ферменты подразделяются на следующие группы:
- Простые гидролазы, лиазы и изомеразы, которые вообще не содержат коферментной базы.
- Белки-ферменты (примеры – некоторые трансаминазы), содержащие простетическую группу (липоевую кислоту, к примеру). К этой группе относятся также многие пероксидазы.
- Энизмы, для которых обязательна регенерация кофермента. К ним относятся киназы, а также большая часть оксидоредуктаз.
- Прочие катализаторы, состав которых пока не до конца изучен.
Все вещества, которые входят в состав первой группы, широко используются в пищевой промышленности. Все прочие катализаторы требуют очень специфических условий для своей активизации, а потому работают только в организме или в некоторых лабораторных опытах. Таким образом, ферментативная функция – это очень специфическая реакция, которая состоит в стимулировании (катализе) некоторых типов реакций в строго определенных условиях организма человека или животного.
Что происходит в активном центре, или Почему ферменты работают настолько эффективно?
Виды специфичности ферментов
Она бывает абсолютной. В этом случае проявляется специфичность только к одному, строго определенному типу фермента. Так, уреаза взаимодействует только с мочевиной. С лактозой молока в реакцию она не вступит ни при каких условиях. Вот какую функцию выполняют белки-ферменты в организме.
Кроме того, нередко встречается абсолютная групповая специфичность. Как можно понять из названия, в этом случае присутствует «восприимчивость» строго к одному классу органических веществ (эфиры, в том числе сложные, спирты или альдегиды). Так, пепсин, который является одним из основных ферментов желудка, проявляет специфичность только в отношении гидролиза пептидной связи. Алкогольдегидраза взаимодействует исключительно со спиртами, а лактикодегидраза не расщепляет ничего, кроме α-оксикислот.
Бывает также, что ферментативная функция характерна для какой-то определенной группы соединений, но при определенных условиях энзимы могут действовать и на довольно отличные от своей основной «цели» вещества. В этом случае катализатор «тяготеет» к определенному классу веществ, но при определенных условиях он может расщеплять и прочие соединения (не обязательно аналогичные). Правда, в этом случае реакция будет идти во много раз медленнее.
Широко известна способность трипсина действовать на пептидные связи, но мало кто знает о том, что этот белок, выполняющий ферментативную функцию в желудочно-кишечном тракте, вполне может вступать во взаимодействие с различными сложноэфирными соединениями.
Наконец, специфичность бывает оптической. Эти ферменты могут взаимодействовать с широчайшим перечнем совершенно разнообразных веществ, но только при том условии, что они имеют строго определенные оптические свойства. Таким образом, ферментативная функция белков в этом случае во многом схожа с принципом действия не ферментов, а катализаторов неорганического происхождения.
Какие факторы определяют эффективность катализа?
- Эффект концентрирования.
- Эффект пространственного ориентирования.
- Многофункциональность активного центра реакции.
В общем-то, суть концентрационного эффекта ничем не отличается от такового в реакции неорганического катализа. В этом случае в активном центре создается такая концентрация субстрата, которая в несколько раз превышает аналогичное значение для всего прочего объема раствора. В центре реакции селективно сортируются молекулы вещества, которое должно прореагировать между собой. Нетрудно догадаться, что именно этот эффект ведет к повышению скорости химической реакции на несколько порядков.
Когда протекает стандартный химический процесс, чрезвычайно важно, какой именно частью взаимодействующие молекулы будут сталкиваться друг с другом. Проще говоря, молекулы вещества в момент столкновения обязательно должны быть строго ориентированы друг относительно друга. За счет того, что в активном центре фермента такой разворот выполняется в принудительном порядке, после чего все участвующие компоненты выстраиваются в определенную линию, реакция катализа ускоряется приблизительно на три порядка.
Под многофункциональностью в данном случае понимается свойство всех составных частей активного центра одновременно (или строго согласованно) действовать на молекулу «обрабатываемого» вещества. При этом она (молекула) не только соответствующим образом фиксируется в пространстве (см. выше), но и в значительной степени изменяет свои характеристики. Все это в совокупности приводит к тому, что ферментам становится куда проще действовать на субстрат необходимым образом.


























