Периодическая система химических элементов - уникальное открытие, навсегда изменившее науку и позволившее предсказывать свойства веществ. Д.И. Менделеев совершил революцию в химии, систематизировав все известные элементы.
История создания периодической системы
К середине XIX века ученые накопили обширные сведения о физических и химических свойствах разных химических элементов и их соединений. Возникла потребность упорядочить эти данные и представить их в наглядном виде.
Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Эту задачу пытался решить и молодой русский профессор Д.И. Менделеев. Он изучал свойства элементов, проводил многочисленные эксперименты, а затем систематизировал собранные данные. Длительные научные изыскания привели его к открытию периодического закона:
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
Свое открытие Менделеев проиллюстрировал в таблице из 63 химических элементов. При ее создании ученый предпринял ряд смелых шагов:
- Изменил ошибочно вычисленные атомные массы некоторых элементов
- Оставил места для еще не открытых элементов, подробно описав их свойства
Сначала мировое научное сообщество скептически отнеслось к периодической системе. Но вскоре были обнаружены предсказанные Менделеевым элементы: галлий, скандий и германий. Это полностью подтвердило правильность его системы, которая навсегда изменила химию.

Современная трактовка периодического закона
Открытия в области строения атома позволили установить, что свойства элементов зависят не от атомной массы, а от заряда атомного ядра, определяемого количеством протонов. Поэтому современная формулировка периодического закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип и лежит в основе структуры периодической системы химических элементов.
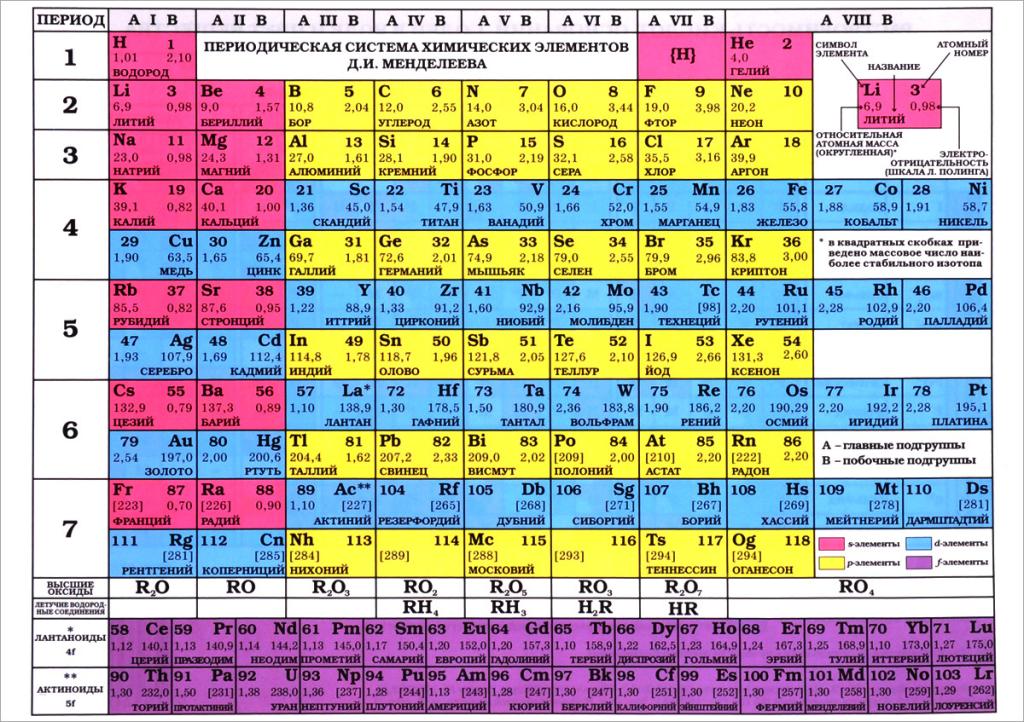
Общая структура периодической системы
На данный момент периодическая система содержит 118 химических элементов. Каждый занимает свое место в зависимости от атомного номера - количества протонов в ядре атома данного элемента.
Периоды - это горизонтальные ряды элементов, расположенных по возрастанию атомных номеров. Всего насчитывается 7 периодов, их номера соответствуют количеству заполненных электронных слоев в атомах элементов данного периода.
Группы - это вертикальные столбцы. Выделяют 8 групп, каждая из которых делится на главную (А) и побочную (B) подгруппы. В группах объединены элементы со сходным числом валентных электронов.
Также выделяют два ряда элементов со сходными свойствами, расположенных отдельно под основной таблицей:
- Лантаноиды (редкоземельные металлы)
- Актиноиды (радиоактивные металлы)
Таким образом, зная положение элемента - номер периода, группы и подгруппы, можно определить основные закономерности его свойств.
Изменение свойств элементов
Свойства элементов в периодической системе изменяются закономерно как по группам, так и по периодам.
При движении по группе сверху вниз наблюдаются следующие тенденции:
- Усиливаются металлические свойства
- Увеличивается атомный радиус
- Возрастает основный характер гидроксидов и кислотность водородных соединений неметаллов
А по периоду слева направо:
- Ослабевают металлические и усиливаются неметаллические свойства
- Уменьшается атомный радиус
- Повышается электроотрицательность
Кроме того, элементы крайних групп обладают наиболее выраженными свойствами. Так, щелочные и щелочноземельные металлы легко отдают электроны, а галогены и инертные газы соответствено активно их принимают или вовсе не вступают в реакции.
Ключевые группы неметаллов
В правом верхнем углу структуры периодической системы расположены неметаллы. Выделяют несколько ключевых групп этих элементов с определенными свойствами.
Подгруппа углерода
В четвертой группе главной подгруппы находится подгруппа углерода. Для нее характерно сочетание свойств металлов и неметаллов. Так, углерод и кремний проявляют неметаллические свойства, германий и олово занимают промежуточное положение, а свинец ведет себя как металл.
Подгруппа азота
Пятая группа главной подгруппы называется подгруппой азота или пниктогенами. Элементы этой группы могут как отдавать, так и принимать электроны. Их физические свойства существенно различаются. Так, азот - бесцветный газ, фосфор образует несколько аллотропных модификаций, мышьяк - твердый полуметалл, а висмут - блестящий металл.
Практическое применение элементов
Многие элементы периодической системы широко используются на практике благодаря своим уникальным свойствам.
Металлы в промышленности
Металлы и их сплавы незаменимы в машиностроении, строительстве, производстве инструментов, бытовой техники. Например, алюминий ценится за легкость и пластичность, сталь – за прочность, медь - за электропроводность и теплопроводность.
Неметаллы в быту и технике
Многие неметаллы используются для изготовления полупроводниковых приборов, без которых невозможно современное электронное оборудование. Например, кремний является базовым материалом для производства чипов и микросхем. А азот широко применяется для получения удобрений в сельском хозяйстве.
Структура периодической системы сегодня
С момента создания Д.И. Менделеевым периодическая система значительно пополнилась и продолжает развиваться по мере открытия новых химических элементов.
В настоящее время она насчитывает уже 118 элементов. Последние из них были получены искусственно в лабораториях, так как не существуют в природе. Ученые продолжают поиск элементов с бóльшими атомными номерами.
Таким образом, гениальное открытие русского химика живет и развивается по мере накопления знаний о мире веществ. И структура периодической системы остается фундаментальной основой современной химии.
Как пользоваться периодической системой
Знание структуры периодической системы позволяет химикам эффективно работать с ней и прогнозировать свойства элементов.
Определение свойств элемента
По положению элемента в таблице можно судить о его металлических или неметаллических свойствах, активности в реакциях, электроотрицательности и других характеристиках. Это значительно упрощает изучение незнакомых элементов.
Вычисление числа электронов и нейтронов
Атомный номер элемента соответствует числу протонов и электронов в его атоме. Чтобы найти количество нейтронов, нужно из относительной атомной массы вычесть атомный номер.
Прогнозирование химических реакций
По расположению элементов можно предсказать, какие химические реакции между ними наиболее вероятны, а какие маловероятны или невозможны.
Изучение истории открытия элементов
Периодическая таблица наглядно показывает, какие элементы были известны в разные исторические эпохи, а какие открыты совсем недавно.
Открытие новых элементов
Незанятые места в таблице указывают химикам направления для поиска пока неоткрытых сверхтяжелых элементов с большими атомными номерами.
Таким образом, периодическая система является мощным инструментом познания для исследователей и по-прежнему хранит немало загадок.