Каждый из химических элементов, представленный в оболочках Земли: атмосфере, литосфере и гидросфере - может служить ярким примером, подтверждающим фундаментальное значение атомно-молекулярного учения и периодического закона. Они были сформулированы корифеями естествознания – русскими учеными М. В. Ломоносовым и Д. И. Менделеевым. Лантаноиды и актиноиды – это два семейства, которые содержат по 14 химических элементов, а также сами металлы – лантан и актиний. Их свойства - как физические, так и химические - будут рассмотрены нами в данной работе. Кроме этого, мы установим, как положение в периодической системе водорода, лантаноидов, актиноидов зависит от строения электронных орбиталей их атомов.
История открытия
В конце 18 столетия Ю. Гадолином было получено первое соединение из группы редкоземельных металлов – оксид иттрия. До начала 20 столетия благодаря исследованиям Г. Мозли в химии стало известно о существовании группы металлов. Они располагались в периодической системе между лантаном и гафнием. Еще один химический элемент – актиний, подобно лантану, образует семейство из 14 радиоактивных химических элементов, названных актиноидами. Их открытие в науке произошло, начиная с 1879 года до середины 20 века. Лантаноиды и актиноиды имеют достаточно много черт сходства как в физических, так и в химических свойствах. Это можно объяснить расположением электронов в атомах этих металлов, которые находятся на энергетических уровнях, а именно для лантаноидов это четвертый уровень f-подуровень, а для актиноидов - пятый уровень f-подуровень. Далее мы рассмотрим электронные оболочки атомов вышеназванных металлов более подробно.
Строение внутренних переходных элементов в свете атомно-молекулярного учения
Гениальное открытие строения химических веществ М. В. Ломоносова явилось основой для дальнейшего изучения электронных оболочек атомов. Резерфордовская модель строения элементарной частицы химического элемента, исследования М. Планка, Ф. Гунда позволили ученым-химикам найти правильное объяснение существующим закономерностям периодического изменения физических и химических свойств, которыми характеризуются лантаноиды и актиноиды. Нельзя обойти вниманием и важнейшую роль периодического закона Д. И. Менделеева в изучении строения атомов переходных элементов. Остановимся на этом вопросе более детально.
Место внутренних переходных элементов в периодической системе Д. И. Менделеева
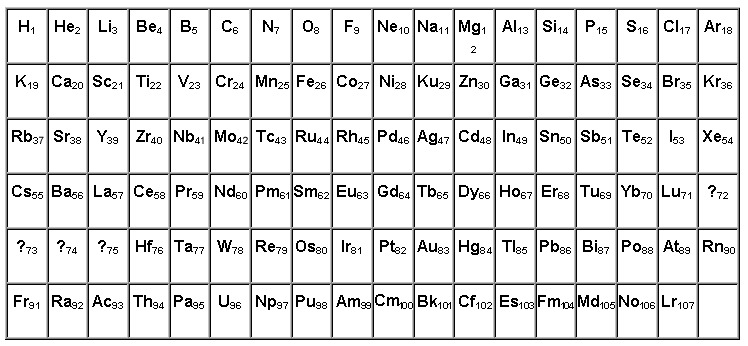
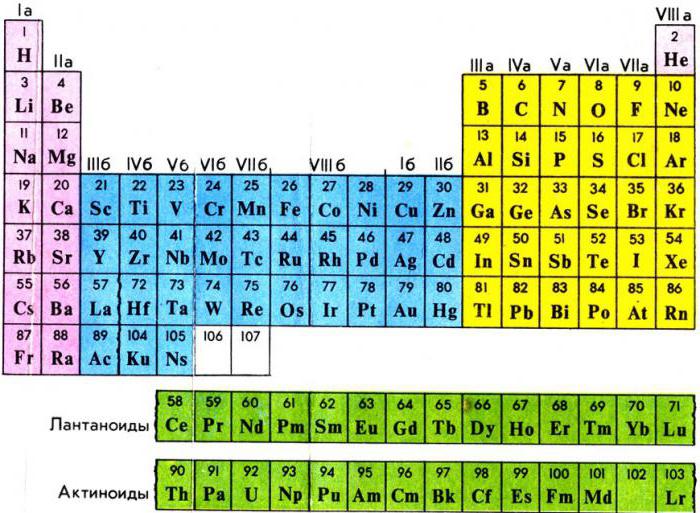
В третьей группе шестого – большего периода - за лантаном находится семейство металлов, расположенных от церия и до лютеция включительно. У атома лантана 4f-подуровень пустой, а у лютеция полностью наполнен 14-ю электронами. У элементов, расположенных между ними, идет постепенное заполнение f-орбиталей. В семействе актиноидов – от тория до лоуренсия - соблюдается тот же принцип накопления отрицательно заряженных частиц с единственным отличием: заполнение электронами происходит на 5f-подуровне. Строение же внешнего энергетического уровня и количество отрицательных частиц на нем (равное двум) у всех вышеперечисленных металлов одинаково. Данный факт отвечает на вопрос о том, почему лантаноиды и актиноиды, названные внутренними переходными элементами, имеют много черт сходства.

В некоторых источниках химической литературы представителей обоих семейств объединяют во вторые побочные подгруппы. В них содержится по два металла из каждого семейства. В короткой форме периодической системы химических элементов Д.И Менделеева представители этих семейств выделены из самой таблицы и расположены отдельными рядами. Поэтому положение лантаноидов и актиноидов в периодической системе отвечает общему плану строения атомов и периодичности заполнения электронами внутренних уровней, а присутствие одинаковых степеней окисления послужило причиной объединения внутренних переходных металлов в общие группы. В них химические элементы обладают признаками и свойствами, равнозначными лантану или актинию. Вот почему лантаноиды и актиноиды вынесены из таблицы химических элементов.
Как электронная конфигурация f-подуровня влияет на свойства металлов
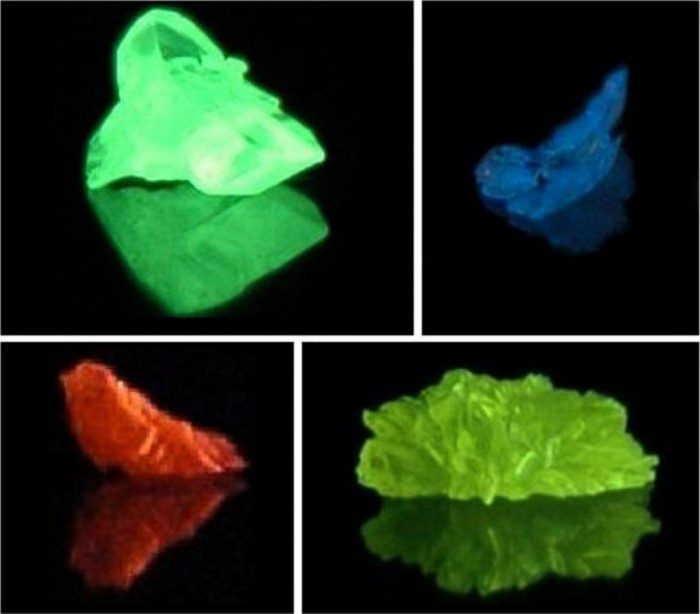
Как мы уже говорили ранее, положение лантаноидов и актиноидов в периодической системе напрямую определяет их физические и химические характеристики. Так, ионы церия, гадолиния и других элементов семейства лантаноидов имеют высокие магнитные моменты, что связано с особенностями строения f-подуровня. Это позволило использовать металлы в качестве легирующих добавок для получения полупроводников с магнитными свойствами. Сульфиды элементов семейства актиния (например, сульфид протактиния, тория) в составе своих молекул имеют смешанный тип химической связи: ионно-ковалентный или ковалентно-металлический. Эта особенность строения привела к появлению нового физико-химического свойства и послужила ответом на вопрос о том, почему лантаноиды и актиноиды обладают люминесцентными свойствами. Например, образец актиния серебристого цвета в темноте светится голубоватым свечением. Это объясняется действием на ионы металлов электрического тока, фотонов света, под влиянием которых происходит возбуждение атомов, а электроны в них «перескакивают» на более высокие энергетические уровни и затем возвращаются на свои стационарные орбиты. Именно по этой причине лантаноиды и актиноиды относятся к люминофорам.
Последствия уменьшения ионных радиусов атомов
У лантана и актиния, как и у элементов из их семейств, наблюдается монотонное снижение величины показателей радиусов ионов металлов. В химии в таких случаях принято говорить о лантаноидном и актиноидном сжатии. В химии установлена следующая закономерность: с увеличением заряда ядра атомов, в случае если элементы относятся к одному и тому же периоду, их радиусы уменьшаются. Объяснить это можно следующим образом: у таких металлов, как церий, празеодим, неодим, количество энергетических уровней в их атомах неизменно и равно шести. Однако заряды ядер соответственно увеличиваются на единицу и составляют +58, +59, +60. Это значит, что возрастает сила притяжения электронов внутренних оболочек к положительно заряженному ядру. Как следствие происходит уменьшение радиусов атомов. В ионных соединениях металлов с увеличением порядкового номера ионные радиусы также уменьшаются. Аналогичные изменения наблюдаются и у элементов семейства актиния. Вот почему лантаноиды и актиноиды называют близнецами. Уменьшение радиусов ионов приводит в первую очередь к ослаблению основных свойств гидроксидов Се(ОН)3, Pr(OH)3, а основание лютеция уже проявляет амфотерные свойства.
К неожиданным результатам приводит заполнение 4f-подуровня неспаренными электронами до половины орбиталей у атома европия. У него радиус атома не уменьшается, а, наоборот, увеличивается. У следующего за ним в ряду лантаноидов гадолиния на 5d-подуровне появляется один электрон 4f-подуровня аналогично Eu. Такое строение вызывает скачкообразное уменьшение радиуса атома гадолиния. Подобное явление наблюдается в паре иттербий – лютеций. У первого элемента радиус атома большой по причине полного заполнения 4f-подуровня, а у лютеция он скачкообразно уменьшается, так как на 5d-подуровне наблюдается появление электронов. У актиния и других радиоактивных элементов этого семейства радиусы их атомов и ионов изменяются не монотонно, а, так же как и у лантаноидов, скачкообразно. Таким образом, лантаноиды и актиноиды являются элементами, у которых свойства их соединений коррелятивно зависят от ионного радиуса и строения электронных оболочек атомов.
Валентные состояния
Лантаноиды и актиноиды являются элементами, чьи характеристики достаточно сходны. В частности, это касается их степеней окисления в ионах и валентности атомов. Например, торий и протактиний, проявляющие валентность, равную трём, в соединениях Th(OH)3, PaCl3, ThF3, Pa2(CO3)3. Все эти вещества являются нерастворимыми и имеют те же химические свойства, что и металлы из семейства лантана: церий, празеодим, неодим и т. д. Лантаноиды в этих соединениях также будут трехвалентными. Эти примеры еще раз доказывают нам правильность утверждения, что лантаноиды и актиноиды – близнецы. Они обладают сходными физическими и химическими свойствами. Это можно объяснить прежде всего строением электронных орбиталей у атомов обоих семейств внутренних переходных элементов.
Металлические свойства
Все представители обеих групп являются металлами, у которых достраиваются 4f-, 5f-, а также d-подуровни. Лантан и элементы его семейства называют редкоземельными. Их физические и химические характеристики настолько близки, что по отдельности в лабораторных условиях они разделяются с большим трудом. Проявляя чаще всего степень окисления +3, элементы ряда лантана имеют много сходных черт со щелочноземельными металлами (барием, кальцием, стронцием). Актиноиды также являются чрезвычайно активными металлами, к тому же еще и радиоактивными.
Особенности строения лантаноидов и актиноидов касаются и таких свойств, как, например, пирофорность в мелкодисперсном состоянии. Наблюдается также уменьшение размеров гранецентрированных кристаллических решеток металлов. Добавим, что все химические элементы обоих семейств – это металлы с серебристым блеском, из-за высокой реакционной способности быстро темнеющие на воздухе. Они покрываются пленкой соответствующего оксида, защищающей от дальнейшего окисления. Все элементы достаточно тугоплавки, за исключением нептуния и плутония, температура плавления которых значительно ниже 1000 °С.
Характерные химические реакции
Как было отмечено ранее, лантаноиды и актиноиды являются химически активными металлами. Так, лантан, церий и другие элементы семейства легко соединяются с простыми веществами – галогенами, а также с фосфором, углеродом. Лантаноиды могут также взаимодействовать как с монооксидом углерода, так и с углекислым газом. Они также способны разлагать воду. Кроме простых солей, например таких как SeCl3 или PrF3, они образуют двойные соли. В аналитической химии важное место занимают реакции металлов-лантаноидов с аминоуксусной и лимонной кислотами. Образующиеся в результате таких процессов комплексные соединения применяются для разделения смеси лантаноидов, например в рудах.

При взаимодействии с нитратной, хлоридной и сульфатной кислотами, металлы образуют соответствующие соли. Они хорошо растворимы в воде и легко способны к образованию кристаллогидратов. Нужно отметить, что водные растворы солей лантаноидов окрашены, что объясняется присутствием в них соответствующих ионов. Растворы солей самария или празеодима зеленого цвета, неодима – красно-фиолетового, прометия и европия – розового. Так как ионы со степенью окисления +3 окрашены, это используется в аналитической химии для распознавания ионов металлов-лантаноидов (так называемые качественные реакции). Для этой же цели применяют еще и такие методы химического анализа, как дробная кристаллизация и ионообменная хроматография.
У актиноидов можно выделить две группы элементов. Это берклий, фермий, менделевий, нобелий, лоуренсий и уран, нептуний, плутоний, омереций. Химические свойства первой из них подобны лантану и металлам из его семейства. Элементы второй группы обладают очень похожими химическими характеристиками (практически идентичны друг другу). Все актиноиды быстро взаимодействуют с неметаллами: серой, азотом, углеродом. С кислородсодержащими легандами они образуют комплексные соединения. Как видим, металлы обоих семейств близки между собой по химическому поведению. Вот почему лантаноиды и актиноиды часто называют металлами-близнецами.
Положение в периодической системе водорода, лантаноидов, актиноидов
Нужно учитывать тот факт, что водород является достаточно реакционноспособным веществом. Он проявляет себя в зависимости от условий химической реакции: как восстановителем, так и окислителем. Именно поэтому в периодической системе водород располагается одновременно в главных подгруппах сразу двух групп.

В первой водород играет роль восстановителя, как и щелочные металлы, расположенные здесь. Место водорода в 7-й группе наряду с элементами галогенами указывает на его восстановительную способность. В шестом периоде находится, как уже ранее было сказано, семейство лантаноидов, вынесенное в отдельный ряд для удобства и компактности таблицы. Седьмой период содержит группу радиоактивных элементов, по своим характеристикам подобным актинию. Актиноиды располагаются вне таблицы химических элементов Д.И Менделеева под рядом семейства лантана. Эти элементы наименее изучены, так как ядра их атомов очень неустойчивы по причине радиоактивности. Напомним, что лантаноиды и актиноиды относятся к элементам внутренним переходным, а их физико-химические характеристики очень близки между собой.
Общие способы получения металлов в промышленности
За исключением тория, протактиния и урана, которые добывают прямым путем из руд, остальные актиноиды можно получить путем облучения образцов металлического урана быстродвижущимися потоками нейтронов. В промышленных масштабах нептуний и плутоний добывают из отработанного топлива ядерных реакторов. Отметим, что получение актиноидов – это достаточно сложный и дорогостоящий процесс, основными методами которого являются ионный обмен и многостадийная экстракция. Лантаноиды, которые называют редкоземельными элементами, получают путем электролиза их хлоридов или фторидов. Чтобы добыть сверхчистые лантаноиды, используют металлотермический метод.

Где применяют внутренние переходные элементы
Спектр использования изучаемых нами металлов достаточно широк. Для семейства актиния – это, прежде всего, ядерное оружие и энергетика. Важное значение имеют актиноиды и в медицине, дефектоскопии, активационном анализе. Нельзя обойти вниманием применение лантаноидов и актиноидов в качестве источников захвата нейтронов в ядерных реакторах. Лантаноиды же применяют в качестве легирующих добавок к чугуну и стали, а также в производстве люминофоров.
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.

Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.