Одним из камней преткновения на первых шагах изучения химических закономерностей и основ является написание химических реакций. Поэтому вопросы о взаимодействии CaCl2, H2SO4 встречаются даже не периодически, а систематически. Разберем основные «проблемные» моменты.
Запись молекулярного уравнения
Взаимодействие между хлоридом кальция (соль) и серной кислотой протекает по обменному механизму.
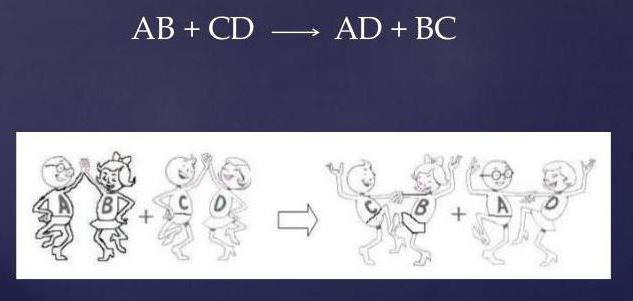
- два соединения на входе (исходные вещества);
- два соединения на выходе (продукты);
- полное отсутствие простых веществ.
Обмениваясь друг с другом реакционными группами, реагенты видоизменяются, а уравнение принимает вид:
CaCl2 + H2SO4 = CaSO4 + 2HCl.
Как видно, два сложных вещества, меняясь ионами, образуют совершенно иные соединения: новую соль (CaSO4) и соляную кислоту (HCl).
Возможность протекания до конца
Ответить на сей вопрос можно запросто, записав для CaCl2, H2SO4 уравнение реакции в молекулярном виде. От вида продуктов и будет всё зависеть. До конца процесс идет в случае образования:
- труднорастворимого вещества (осадка);
- летучего соединения (газа);
- малодиссоциирущего реагента (воды, слабого электролита).
В рассматриваемом для CaCl2, H2SO4 случае среди продуктов реакции имеется сульфат кальция – малорастворимое соединение, выпадающее в осадок, согласно таблице.
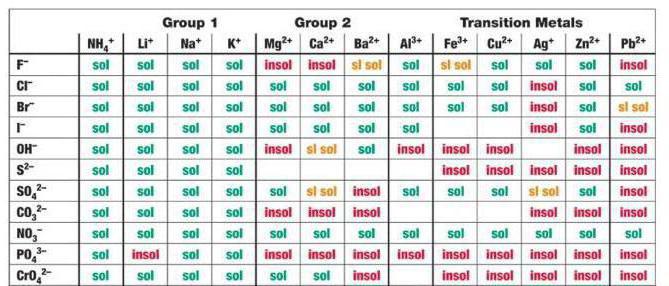
Следовательно, обменный процесс пройдет до конца.
Сокращенная ионная форма записи между CaCl2, H2SO4
Расписав все растворимые соединения на ионы и сократив повторяющиеся реакционные группы, получим два искомых уравнения:
- полная ионная форма записи между CaCl2, H2SO4
ca2+ + 2cl- + 2h+ + so42- = caso4 + 2h+ + 2cl-
- сокращенный вид уравнения
ca2+ + so42- = caso4.
Следует помнить, что на ионы расписываются только растворимые соли, кислоты, основания (это легко определяется по специальным таблицам). Слабые электролиты типа угольной или уксусной кислоты всегда пишутся в молекулярной форме.
Теперь вы знаете, как происходит взаимодействие между хлоридом кальция (соль) и серной кислотой.


















