Часто от приличных на вид людей можно услышать о вреде для здоровья какого-то продукта или средства. Причем главным аргументом в пользу такого утверждения будет фраза: «Это химия!». Однако так говорить могут лишь те, кто в школе явно прогуливал уроки по данному предмету. Дело в том, что человеческий, да и любой биологический организм, сам по себе состоит из множества органических и неорганических веществ. При этом поддерживать его жизнеспособность помогают различные процессы, непрерывно происходящие внутри него. Одним из главных среди них - является химическая реакция разложения. Давайте узнаем больше о ней и особенностях ее протекания с органическими и неорганическими веществами.
Что за процесс называется химической реакцией
Прежде всего, стоит узнать значение понятия «химическая реакция». Это словосочетание означает превращение одного и более исходных веществ (называются реагентами) в другие. В процессе подобной метаморфозы ядра атомов взаимодействующих соединений не поддаются изменениям, однако происходит перераспределение электронов. Таким образом, после превращения на выходе образуются новые атомные соединения.

Химические реакции имеют качественное отличие от физических и ядерных.
- В результате первых исходные реагенты никогда не меняют свой состав, хотя и способны образовывать смеси или переходить из одного агрегатного состояния в другое. В отличие от них, процессы химические сопровождаются образованием новых соединений, с совершенно иными свойствами.
- Результатом вторых является изменения изотопного состава и числа атомов. Таким образом, на выходе из одних элементов, образовываются другие. Однако для химических процессов, столь глубокие метаморфозы не характерны. Поскольку изменения, произошедшие из-за них, не влияют на внутреннюю структуру атомов.
Условия протекания химических реакций
Во многих случаях, для успешного протекания процессов такого рода, необходим просто физический контакт реагентов друг с другом или их смешивание. Но часто для начала химической реакции, ей необходимы катализаторы. В этой роли могут выступать как различные вещества, так и определенные внешние условия.

- Воздействие температуры. Для того чтобы запустить отдельные химические процессы, необходимо нагревать реагенты. К примеру, чтобы начать реакцию разложения карбоната кальция, это температуру этого соединений необходимо повысить до 900-1200 °C.
- Электромагнитные волны. Наиболее эффективно стимулирующей протекание любых процессов является воздействие на реагенты световыми волнами. Такие реакции носят название «фотохимические». Классическим примером такой реакции является фотосинтез.
- Ионизирующее излучение.
- Воздействие электрического тока.
- Разного рода механическое влияние на реагирующие вещества.
Какие виды химических реакций существуют
Классификация подобных процессов в основном производится по шести признакам.
- По наличию границы разделения фаз: гомо-/гетерогенные реакции.
- По выделению/поглощению тепла: экзотермически и эндотермические процессы.
- По наличию/отсутствию катализаторов: каталитические и некаталитические реакции.
- По направлению протекания: обратимые и необратимые процессы. В зависимости от данной категории находится тип знака между левой и правой частями химического уравнения. При необратимых - это две стрелки направленные в противоположные стороны, при обратимых - только одна, направленная слева на право.
- По изменению степени окисления. По этому принципу выделяют окислительно-восстановительную реакцию.
- Разложение (расщепление), соединение, замещение и обмен – это виды химических процессов по типу метаморфоз реагентов.
Реакция разложения (расщепления): что это
Под данным термином подразумевается процесс, в результате которого одно сложное вещество разделяется на два и более простых. В большинстве случаев катализатором для этого выступает высокая температура. По этой причине данный процесс еще называют реакцией термического разложения.
В качестве примера можно привести один из классических способов получения чистого кислорода (О2) в промышленности. Это происходит в следствии нагревании KMnO4 (более известен всем под бытовым названием «марганцовка»).

В результате расщепления образуется не только кислород, но и манганат калия (K2MnO4) , а также диоксид марганца (MnO2).
Уравнение реакции разложения
Любое химическое уравнение состоит из двух частей: левой и правой. В первой из них записываются реагирующие соединения, а во второй – продукты реакции. Между ними обычно ставится направленная вправо стрелка. Иногда она бывает двухсторонней, если речь идет об обратимом процессе. В отдельных случаях ее допустимо заменить знаком равенства (=).
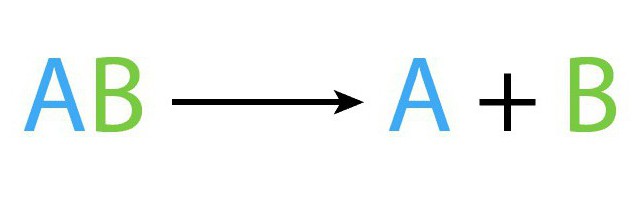
Рассматриваемый процесс, как и остальные виды химических процессов, имеет собственную формулу. Схематически уравнение реакции разложения выглядит таким образом: AB (t) → A+B.
Стоит помнить, что преимущественное большинство таких процессов происходит под воздействием тепла. Чтобы сообщить об этом, над стрелкой или рядом с ней часто ставится либо литера t, либо треугольник. Однако, иногда вместо тепла, в роли катализаторов выступают различные вещества, излучения.
В рассмотренной выше формуле AB - то исходное сложное соединения, A, B – это новые вещества, образованные в результате реакции разложения.
Примеры практические такого процесса встречаются очень часто. Можно проиллюстрировать данную формулу, с помощью уравнения процесса, описанного в предыдущем пункте: 2KMnO4 (t) → K2MnO4 + MnO2 + O2↑.
Виды реакций разложения
В зависимости от типа катализатора (который способствует расщеплению сложного вещества на более простые) выделяют несколько видов разложения.
- Биодеградация – распад веществ вследствие деятельности живых организмов (микроорганизмы, грибы, водоросли). Более простым языком данный процесс можно назвать гниением. Именно из-за него портятся продукты. В одной стороны это препятствует их долгому хранению, с другой – помогает природе утилизировать все лишнее, восстанавливая таким образом экосистемы.
- Радиолиз – распад соединений при помощи воздействия на их молекулы ионизирующим излучением.
- Термолиз – повышение температуры для того, чтобы запустить реакцию разложения (примеры подобных процессов можно найти в пунктах 8-9).
Этот вид расщепления имеет подвид – пиролиз. От обычного термолиза он отличается тем, что помимо воздействия высокой температуры на молекулы вещества, также их лишают возможности взаимодействовать с кислородом (О2). - Сольволиз – обменное разложения между растворенным веществом и непосредственно самим растворителем. В зависимости от типа последнего, выделяются такие виды этого процесса: гидролиз (вода), алколиз (спирты), аммонолиз (амиак).
- Электролиз – разложение молекул с помощью воздействия на них электрического тока (пример в следующем пункте).
Расщепление Н2О
Разобравшись с теорией, касающейся реакции разложения, примеры практические ее проведения стоит рассмотреть. Поскольку Н2О сегодня является одним из наиболее доступных веществ для проведения химических опытов, стоит начать с нее.
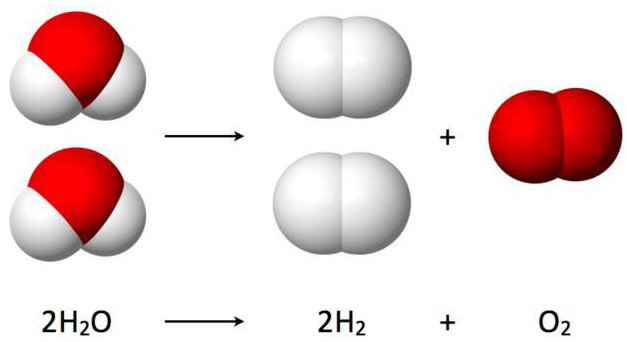
Данная реакция разложения воды именуется еще электролизом и выглядит таким образом: 2Н2О (электрический ток) → 2Н2↑ + О2↑.
Расшифровывается данное уравнение так: под воздействием на молекулы воды электрического тока, они расщепляют и образуют два газа – кислород и водород.
Стоит отметить, что этот метод активно используется на подводных лодках для получения кислорода. В современном мире он заменил более дорогой способ получения этого жизненно важного вещества из пероксида натрия (Na2O2), с помощью его взаимодействия с углекислым газом: Na2O2 + CO2↑ → Na2CO3 + O2↑.
В перспективе реакция разложения воды может иметь огромное значение для будущего планеты. Поскольку таким образом можно добывать не только кислород, но и водород, использующийся как ракетное топливо. Разработки в этой области уже ведутся многие годы, однако основной проблемой является необходимость снизить количество энергозатрат на расщепление молекул воды.
Расщепление Н2О2
Среди других примеров реакции разложения стоит обратить внимание на образование воды и кислорода из пероксида водорода (перекись).
Выглядит она таким образом: Н2О2 (t) → 2Н2О + О2↑.
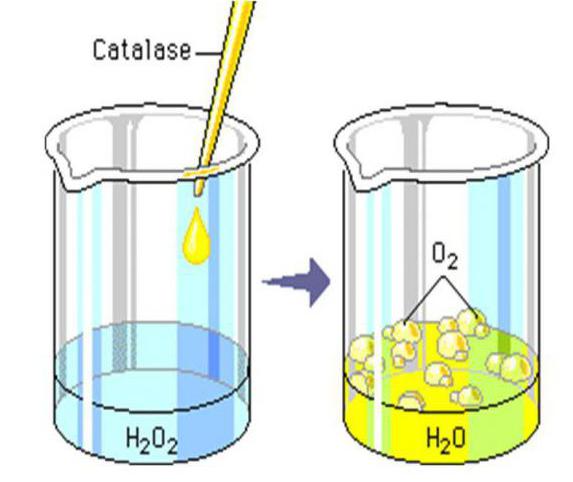
Данный процесс также является термическим, поскольку для его начала, необходимо, чтобы исходное веществ было нагрето до температуры в 150 °C.
Именно по этой причине, перекись водорода (которую большинство использует для обработки ран) не превращается в воду, стоя в домашних аптечках.
Однако стоит помнить, что реакция разложения пероксида водорода может происходить и при обычной комнатной температуре, если вещество контактирует с такими соединениями, как каустическая сода (NaOH) или диоксид марганца (MnO2). Также в роли катализаторов могут выступать платина (Pt) и купрум (Cu).
Реакция термического разложения CaCO3
Еще одним интересным примером может служить расщепление карбоната кальция. Данный процесс можно записать с помощью такого уравнения: CaCO3 (t) → CaO + CO2↑.
Продуктом этой реакции буде негашеная известь (оксид кальция) и углекислый газ.
Представленный выше процесс активно используется в промышленности для получения углекислого газа. Подобные реакции производятся в специализированных шахтах, поскольку расщепление карбоната кальция происходит лишь при температуре от 900 °C.



























