Ацетиленид меди является металлорганическим бинарным соединением. Данная формула известна науке по крайней мере с 1856 года. В кристаллах образует моногидрат с формулой Cu2C2×H2O. Термически неустойчив, при нагревании взрывается.
Строение
Ацетиленид меди является бинарным соединением. Можно условно выделить в нем отрицательно заряженную часть - анион C2−2, и положительно заряженную - катионы меди Cu+. На самом деле такое деление условно: в соединении есть лишь доля ионной связи, хотя она больше по сравнению со связью H-C≡. Но и указанная связь имеет очень сильную полярность (как для ковалентной) из-за того, что атом углерода с тройной связью находится в sp-гибридизации - его относительная электроотрицательность больше, чем в гибридизациях sp3 (одинарная связь) или sp2 (двойная связь). Именно это позволяет углероду в ацетилене сравнительно легко отщеплять от себя атом водорода и замещать его атомом металла, то есть проявлять свойства, присущие кислотам.
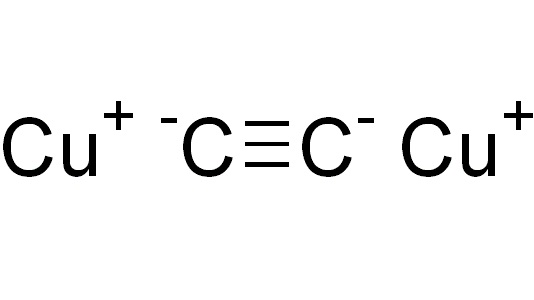
Получение
Наиболее распространенный способ получения ацетиленида меди в лаборатории - пропускание газообразного ацетилена сквозь аммиачный раствор хлорида меди(I). В результате образуется нерастворимый осадок ацетиленида красноватого цвета.
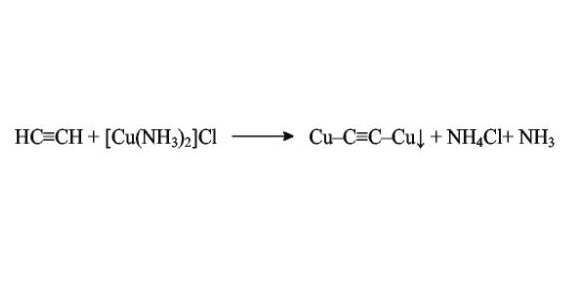
Вместо хлорида меди(I) также можно использовать ее гидроксид Cu2O. В обоих случаях важно то, что фактически реакция идет с аммиачным комплексом меди.
Физические свойства
Ацетиленид меди в чистом виде - темные красно-коричневые кристаллы. На самом деле это моногидрат - в осадке каждой молекуле ацетиленида соответствует одна молекула воды (записывается в виде Cu2C2×H2O). Сухой ацетиленид меди взрывоопасен: может сдетонировать при нагревании (он менее термически устойчив, чем ацетиленид серебра), а также при механическом воздействии, например при ударе.
По этому поводу существует предположение, что медные трубы на химических производствах несут большую опасность, так как при длительной эксплуатации внутри образовывается ацетиленид, который потом может привести к сильному взрыву. Особенно это актуально для области нефтехимии, где медь, а также ее ацетилениды используются также и в качестве катализаторов, что повышает уровень риска.
Химические свойства
Мы уже говорили о том, что углерод с тройной связью в ацетилене гораздо более электроотрицателен, чем, например, углерод со связью двойной (как в этилене) или одинарной (в этане). Способность ацетилена реагировать с некоторыми металлами, отдавая ион водорода и замещая его ионом металла (например, реакция образования ацетиленида натрия при взаимодействии ацетилена с металлическим натрием) подтверждает это. Мы называем эту способность ацетилена одним из кислотных свойств в соответствии с теорией Бренстеда - Лоури: согласно ей, кислотность вещества определяется его способностью отщепить от себя протон. Кислотность ацетилена (в ацетилениде меди также) можно рассмотреть относительно аммиака и воды: при взаимодействии амида металла с ацетиленом образуется ацетиленид и аммиак. То есть ацетилен отдает протон, что характеризует его как более сильную, чем аммиак, кислоту. В случае с водой ацетиленид меди разлагается, образуя ацетилен - он принимает протон воды, показывая себя менее сильной кислотой, чем вода. Так, в относительном ряде кислотности (по Бренстеду - Лоури) ацетилен является слабой кислотой, находясь где-то между водой и аммиаком.
Ацетиленид меди(I) неустойчив: в воде (как нам уже известно) и в растворах кислот он разлагается с выделением газа ацетилена и красно-коричневого осадка - оксида меди(I) или белого осадка хлорида меди(I) в случае разбавления раствором соляной кислоты.
Чтобы избежать взрыва, разложение ацетиленида проводят аккуратным нагреванием во влажном виде в присутствии сильной минеральной кислоты, например разбавленной азотной.
Использование
Реакция образования ацетиленида меди(I) может быть качественной для обнаружения терминальных (с тройной связью на конце) алкинов. Индикатором является выпадения нерастворимого красно-коричневого осадка ацетиленида.
На крупнотоннажном производстве - например, в нефтехимии - ацетиленид меди(I) не используется, поскольку взрывоопасен и неустойчив в воде. Однако с ним связаны несколько специфичных реакций в так называемом тонком синтезе.
Ацетиленид меди(I) также может использоваться в качестве нуклеофильного реагента в органическом синтезе. В частности, важную роль он играет в процессе синтеза полиинов - соединений с несколькими чередующимися тройными и одинарными связями. Ацетилениды меди(I) в спиртовом растворе окисляются кислородом воздуха, конденсируясь с образованием диинов. Это реакция Глазера - Эллингтона, открытая в 1870 году и позже усовершенствованная. Медь(I) здесь играет роль катализатора, так как сама в процессе не расходуется.
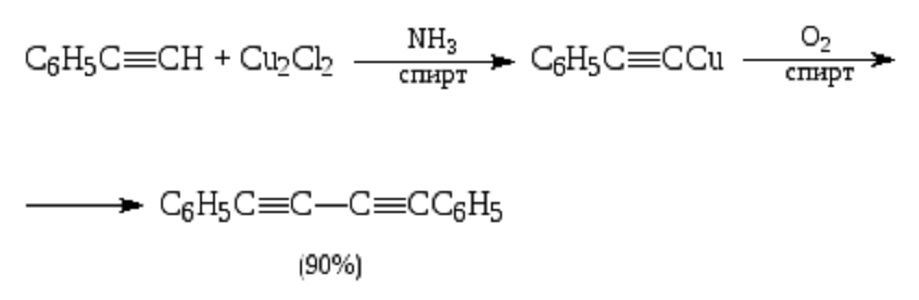
Позже вместо кислорода в качестве окислителя был предложен гексацианоферрат(III) калия.
Эллингтон усовершенствовал метод получения полиинов. Вместо изначально вводившихся в раствор алкинов и солей меди(I), например хлорида он предложил брать ацетат меди(II), который окислял бы алкин в среде уже другого органического растворителя - пиридина - при температуре 60-70 °С.
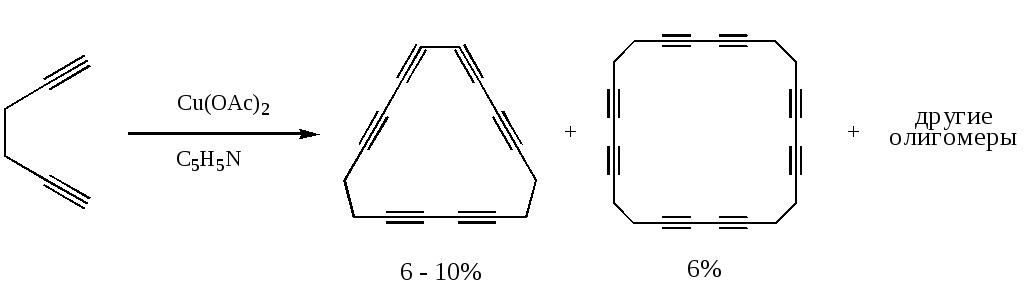
Такая модификация позволила получать из диинов гораздо более крупные и устойчивые молекулы - макроциклы.



























