Каждый класс химических соединений способен проявлять свойства, обусловленные их электронным строением. Для алканов характерны реакции замещения, отщепления или окисления молекул. Все химические процессы имеют свои особенности протекания, о которых пойдет дальше речь.
Что такое алканы
Это насыщенные углеводородные соединения, которые носят название парафинов. Их молекулы состоят только из атомов углеродных и водородных, имеют линейную или разветвленную ациклическую цепочку, в которой есть лишь одинарные соединения. Учитывая характеристику класса, можно вычислить, какие реакции характерны для алканов. Они подчиняются формуле для всего класса: H2n+2Cn.
Строение химическое
Молекула парафинов включает углеродные атомы, проявляющие sp3-гибридизацию. У них все валентные четыре орбитали обладают одинаковой формой, энергией и направлением в пространстве. Размер угла между энергетическими уровнями составляет 109° и 28'.
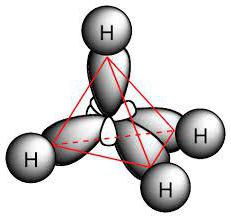
Наличие одинарных связей в молекулах определяет, какие реакции характерны для алканов. В них присутствуют σ-соединения. Связь между углеродами является неполярной и слабо поляризуемой, она немного длиннее, чем в C−H. Также наблюдается смещение электронной плотности к углеродному атому, как наиболее электроотрицательному. В результате соединение C−H характеризуется малой полярностью.
Реакции замещения
Вещества класса парафинов обладают слабой химической активностью. Это можно объяснить прочностью связей между C−C и C−H, которые трудно разорвать из-за неполярности. В основе их разрушения лежит механизм гомолитический, при котором участвуют радикалы свободного типа. Именно поэтому для алканов характерны реакции замещения. Такие веществ не способны взаимодействовать с молекулами воды или несущими заряд ионами.
Им причисляют замещение свободнорадикальное, в котором водородные атомы заменяются на галогеновые элементы или другие активные группы. К таким реакциям относят процессы, связанные с галогенированием, сульфохлорированием и нитрованием. Их результатом является получение алкановых производных.
- Начинается процесс с инициирования или зарождения цепочки, в результате которого формируются свободные радикалы. Катализаторами служат источники света ультрафиолетового и нагревание.
- Затем развивается цепочка, в которой осуществляются последовательные взаимодействия активных частиц с неактивными молекулами. Происходит их превращение в молекулы и радикалы соответственно.
- Конечным этапом будет обрыв цепочки. Наблюдается рекомбинация или исчезновение активных частиц. Так прекращается развитие цепной реакции.
Процесс галогенирования
В его основе лежит механизм радикального типа. Реакция галогенирования алканов проходит при облучении ультрафиолетом и нагревании смеси из галогенов и углеводородов.
Все стадии процесса подчиняются правилу, которое высказал Марковников. В нем указано, что подвергается замещению галогеном, прежде всего, атом водорода, который принадлежит самому гидрированному углероду. Галогенирование протекает в такой последовательности: от третичного атома до первичного углерода.
Процесс проходит лучше у молекул алканов с длинной основной углеродной цепочкой. Это связано с уменьшением ионизирующей энергии в данном направлении, от вещества легче отщепляется электрон.
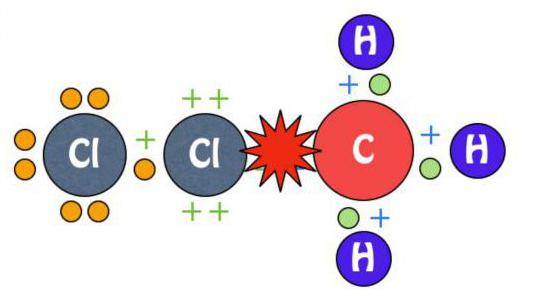
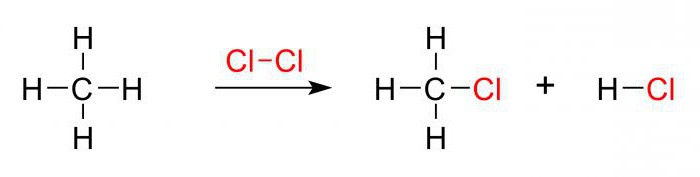
Примером может служить хлорирование молекулы метана. Действие ультрафиолета приводит к расщеплению хлора на радикальные частицы, которые осуществляют атаку на алкан. Происходит отрыв атомарного водорода и формирование H3C· или метильного радикала. Такая частица, в свою очередь, атакует молекулярный хлор, приводя к разрушению ее структуры и образованию нового химического реагента.
На каждом этапе процесса осуществляется замещение только одного водородного атома. Реакция галогенирования алканов приводит к постепенному формированию хлорметановой, дихлорметановой, трихлорметановой и тетрахлорметановой молекулы.
Схематически процесс выглядит следующим образом:
H4C + Cl:Cl → H3CCl + HCl,
H3CCl + Cl:Cl → H2CCl2 + HCl,
H2CCl2 + Cl:Cl → HCCl3 + HCl,
HCCl3 + Cl:Cl → CCl4 + HCl.
В отличие от хлорирования молекулы метана, проведение такого процесса с другими алканами характеризуется получением веществ, у которых замещение водорода происходит не у одного атома углерода, а у нескольких. Их количественное соотношение связано с температурными показателями. В холодных условиях наблюдается уменьшение скорости образования производных с третичной, вторичной и первичной структурой.
С повышением температурного показателя быстрота формирования таких соединений выравнивается. На процесс галогенирования существует влияние фактора статического, который указывает на разную вероятность столкновения радикала с углеродным атомом.
Процесс галогенирования йодом в обычных условиях не протекает. Необходимо создание специальных условий. При воздействии на метан данным галогеном происходит возникновение йодистого водорода. На него оказывает действие йодистый метил, в результате выделяются первоначальные реагенты: метан и йод. Такая реакция считается обратимой.
Реакция Вюрца для алканов
Является методом получения углеводородов насыщенных с симметричной структурой. В качестве реагирующих веществ используют натрий металлический, алкилбромиды или алкилхлориды. При их взаимодействии получают галогенид натрия и увеличенную углеводородную цепь, которая является суммой двух радикалов углеводородов. Схематически синтез выглядит следующим образом: R−Cl + Cl−R + 2Na → R−R + 2NaCl.
Реакция Вюрца для алканов возможна только в том случае, если в их молекулах галогены находятся у первичного углеродного атома. Например, CH3−CH2−CH2Br.
Если в процессе участвует галогенуглеводорододная смесь из двух соединений, то при конденсации их цепочек образуются три разных продукта. Примером такой реакции алканов может служить взаимодействие натрия с хлорметаном и хлорэтаном. На выходе получается смесь, содержащая бутан, пропан и этан.
Кроме натрия, можно применять другие щелочные металлы, к которым относят литий или калий.
Процесс сульфохлорирования
Его еще называют реакцией Рида. Протекает она по принципу свободнорадикального замещения. Это характерный тип реакции алканов на действие смеси из диоксида серы и молекулярного хлора в присутствии ультрафиолетового излучения.
Процесс начинается с инициации цепного механизма, при котором из хлора получаются два радикала. Один из них атакует алкан, что приводит к возникновению алкильной частицы и молекулы хлороводорода. К углеводородному радикалу прикрепляется серы диоксид с формированием сложной частицы. Для стабилизации происходит захват одного хлорного атома из другой молекулы. Конечным веществом является сульфонилхлорид алкана, его применяют при синтезе поверхностно-активных соединений.
Схематически процесс выглядит так:
ClCl → hv ∙Cl + ∙Cl,
HR + ∙Cl → R∙ + HCl,
R∙ + OSO → ∙RSO2,
∙RSO2 + ClCl → RSO2Cl + ∙Cl.
Процессы, связанные с нитрованием
Алканы вступают в реакции с кислотой азотной в виде раствора 10%, а также с азота четырехвалентного оксидом в газообразном состоянии. Условиями ее протекания являются высокие температурные значения (около 140 °C) и низкие показатели давления. На выходе продуцируются нитроалканы.
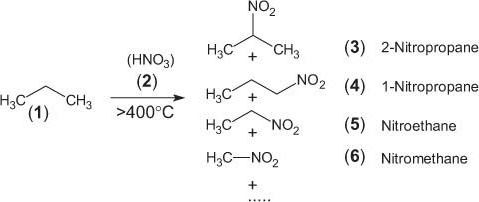
Данный процесс свободнорадикального типа назвали в честь ученого Коновалова, открывшего синтез нитрования: CH4 + HNO3 → CH3NO2 + H2O.
Механизм отщепления
Для алканов характерны реакции дегидрирования и крекинга. Молекула метана подвергается полному термическому разложению.
Основным механизмом вышеуказанных реакций является отщепление атомов от алканов.
Процесс дегидрирования
При отделении атомов водорода от углеродного скелета парафинов, за исключением метана, получаются непредельные соединения. Такие химические реакции алканов проходят в условиях высокой температуры (от 400 до 600 °C) и под действием ускорителей в виде платины, никеля, оксидов хрома и алюминия.
Если в реакции участвуют молекулы пропана или этана, то ее продуктами будет пропен или этен с одной двойной связью.
При дегидрировании четырех или пятиуглеродного скелета получаются диеновые соединения. Из бутана формируются бутадиен-1,3 и бутадиен-1,2.
Если в реакции присутствуют вещества с 6 и более атомами углеродов, то образуется бензол. В нем имеется ароматическое ядро с тремя связями двойными.
Процесс, связанный с разложением
В условиях высокой температуры реакции алканов могут проходить с разрывом связей углеродных и формированием активных частиц радикального типа. Такие процессы называют крекингом или пиролизом.
Нагревание реагирующих веществ до температур, превышающих 500 °C, приводит к разложению их молекул, в ходе которого образуются сложные смеси из радикалов алкильного типа.
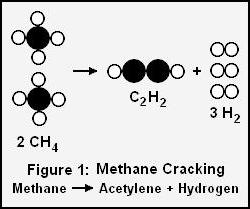
Проведение при сильном нагревании пиролиза алканов с длинными углеродными цепочками связано с получением предельных и непредельных соединений. Его называют термическим крекингом. Такой процесс использовали до середины 20 века.
Недостатком было получение углеводородов с низким октановым числом (не более 65), поэтому его заменили крекингом каталитическим. Процесс проходит при температурных условиях, которые ниже 440 °C, и значениях давления, меньше 15 атмосфер, в присутствие алюмосиликатного ускорителя с выделением алканов, имеющих разветвлённую структуру. Примером может служить метановый пиролиз: 2CH4 →t°C2H2+ 3H2. В ходе данной реакции образуется ацетилен и молекулярный водород.
Молекула метана может подвергаться конверсии. Для такой реакции необходима вода и никелевый катализатор. На выходе получается смесь из угарного газа и водорода.
Окислительные процессы
Химические реакции, характерные для алканов, связаны с отдачей электронов.
Существует автоокисление парафинов. В нем задействован свободно-радикальный механизм окисления насыщенных углеводородов. В ходе реакции из жидкой фазы алканов получают гидроперекиси. На начальном этапе молекула парафина взаимодействует с кислородом, в результате выделяются активные радикалы. Далее с алкильной частицей взаимодействует еще одна молекула O2, получается ∙ROO. С перекисным радикалом жирной кислоты контактирует молекула алкана, после чего выделяется гидроперекись. Примером может служить автоокисление этана:
C2H6 + O2 → ∙C2H5 + HOO∙,
∙C2H5 + O2 → ∙OOC2H5,
∙OOC2H5 + C2H6 → HOOC2H5 + ∙C2H5.
Для алканов характерны реакции горения, которые относятся к главным химическим свойствам, при определении их в составе топлива. Они имеют окислительный характер с выбросом тепла: 2C2H6 + 7O2 → 4CO2 + 6H2O.
Если в процессе наблюдается малое количество кислорода, то конечным продуктом может быть уголь или углерода двухвалентный оксид, что определяется концентрацией O2.
При окислении алканов под влиянием каталитических веществ и нагревании до 200 °C получаются молекулы спирта, альдегида или карбоновой кислоты.
Пример с этаном:
C2H6 + O2 → C2H5OH (этанол),
C2H6 + O2 → CH3CHO + H2O (этаналь и вода),
2C2H6 + 3O2 → 2CH3COOH + 2H2O (этановая кислота и вода).
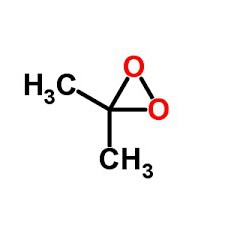
Алканы могут окисляться при действии на них трёхчленных циклических пероксидов. К ним относят диметилдиоксиран. Результатом окисления парафинов является молекула спирта.
Представители парафинов не реагируют на KMnO4 или марганцовокислый калий, а также на бромную воду.
Изомеризация
На алканы тип реакции характеризуется замещением с электрофильным механизмом. Сюда причисляют изомеризацию углеродной цепи. Катализирует данный процесс алюминия хлорид, который взаимодействует с насыщенным парафином. Примером служит изомеризация молекулы бутана, которая становится 2-метилпропаном: C4H10 → C3H7CH3.
Процесс ароматизации
Насыщенные вещества, у которых в основной цепочке углеродной содержится шесть или больше атомов углеродных, способны проводить дегидроциклизацию. Для коротких молекул не характерна такая реакция. Результатом всегда является шестичленный цикл в виде циклогексана и его производных.
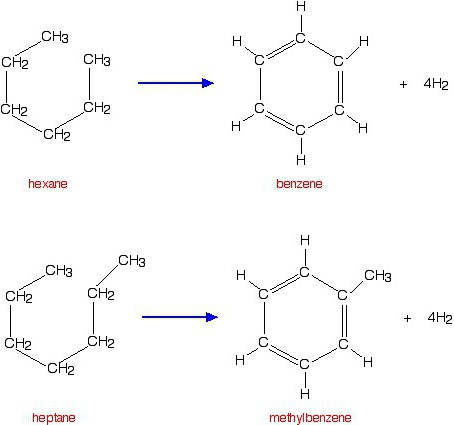
В присутствии реакционных ускорителей проходит дальнейшее дегидрирование и превращение в более устойчивое бензольное кольцо. Происходит превращение ациклических углеводородов в ароматические соединения или арены. В качестве примера служит дегидроциклизация гексана:
H3C−CH2− CH2− CH2− CH2−CH3 → C6H12 (циклогексан),
C6H12 → C6H6 + 3H2 (бензол).