Прежде чем определять самые сильные окислители, постараемся выяснить теоретические вопросы, касающиеся данной темы.
Определение
В химии под окислителем подразумевают нейтральные атомы либо заряженные частицы, которые в процессе химического взаимодействия принимают от других частиц электроны.
Примеры окислителей
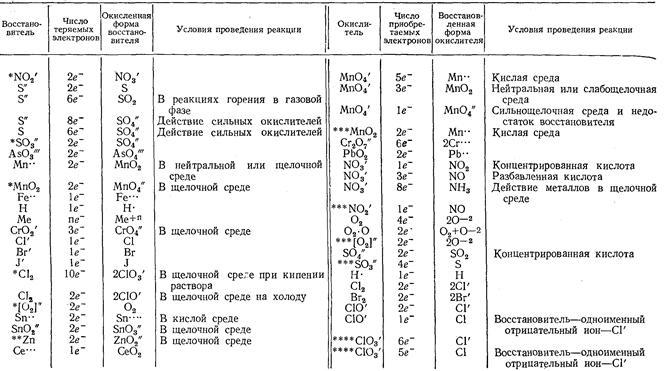
Для того чтобы определить самые сильные окислители, необходимо отметить, что данный показатель зависит от степени окисления. Например, в перманганате калия у марганца она составляет +7, то есть является максимальной.
Данное соединение, более известное как марганцовка, проявляет типичные окислительные свойства. Именно перманганат калия можно использовать в органической химии для проведения качественных реакций на кратную связь.
Определяя самые сильные окислители, остановимся на азотной кислоте. Ее по праву называют царицей кислот, ведь именно это соединение даже в разбавленном виде способно вступать во взаимодействие с металлами, расположенными в электрохимическом ряду напряжений металлов после водорода.
Рассматривая самые сильные окислители, нельзя оставить без внимания соединения хрома. Соли хрома считаются одними из самых ярких окислителей, их используют в качественном анализе.
Группы окислителей
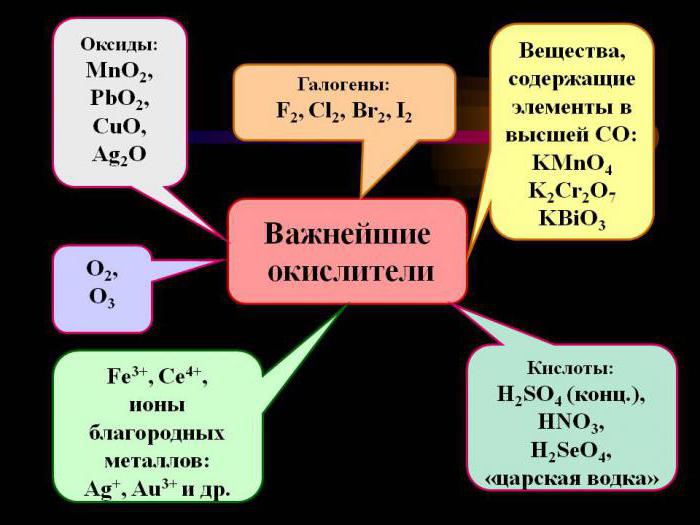
В качестве окислителей можно рассматривать и нейтральные молекулы, и заряженные частицы (ионы). Если анализировать атомы химических элементов, проявляющие подобные свойства, то необходимо, чтобы на внешнем энергетическом уровне у них содержалось от четырех до семи электронов.
Подразумевается, что именно p-элементы проявляют яркие окислительные характеристики, а к ним относятся типичные неметаллы.
Самым сильным окислителем является фтор, представитель подгруппы галогенов.
Среди слабых окислителей можно рассмотреть представителей четвертой группы таблицы Менделеева. Наблюдается закономерное уменьшение окислительных свойств в главных подгруппах при возрастании радиуса атома.
Учитывая подобную закономерность, можно отметить, что минимальные окислительные свойства проявляет свинец.
Самый сильный неметалл-окислитель - это фтор, который не способен отдавать электроны другим атомам.
Такие элементы, как хром, марганец, в зависимости от среды, в которой протекает химическое взаимодействие, могут проявлять не только окислительные, но и восстановительные свойства.
Они могут менять свою степень окисления с меньшей величины на большую, отдавая для этого электроны другим атомам (ионам).
Ионы всех благородных металлов даже в минимальной степени окисления проявляют яркие окислительные свойства, активно вступая в химическое взаимодействие.
Говоря о сильных окислителях, неправильно будет оставить без внимания молекулярный кислород. Именно эта двухатомная молекула считается одним из самых доступных и распространенных видов окислителей, поэтому достаточно широко применяется в органическом синтезе. Например, при наличии окислителя в виде молекулярного кислорода можно превратить этанол в этаналь, что необходимо для последующего синтеза уксусной кислоты. С помощью окисления можно получить из природного газа даже органический спирт (метанол).
Заключение
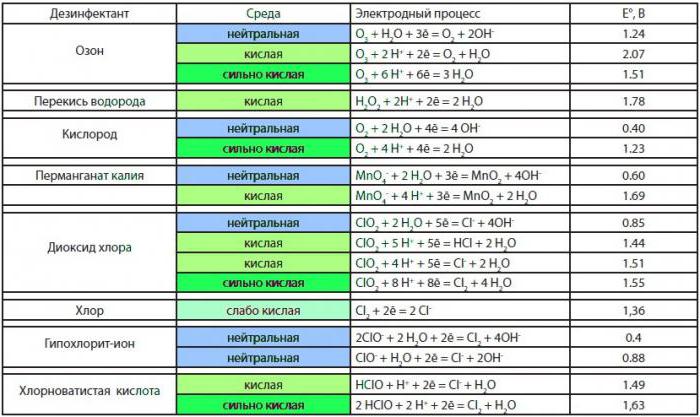
Окислительно-восстановительные процессы имеют важное значение не только для проведения каких-то превращений в химической лаборатории, но и для промышленных производств различных органических и неорганических продуктов. Именно поэтому так важно правильно подбирать окислители, чтобы повысить эффективность протекания реакции, увеличить выход продукта взаимодействия.