В таблице Менделеева такой химический элемент, как мышьяк, занимает позицию на границе металл - неметалл. По своей активности он находится между водородом и медью. Неметаллический характер проявляется в том, что он способен проявлять степень окисления -3 (AsH3 - арсин). Соединения с положительной степенью окисления +3 обладают амфотерными свойствами, а со степенью +5 проявляются его кислотные свойства. Что представляет собой оксид мышьяка?

Оксиды и гидроксиды
Существуют следующие оксиды мышьяка: As2О3 и As2О5. Также есть соответствующие гидроксиды:
- Метамышьяковистая кислота HAsO2.
- Ортомышьяковистая кислота H3AsO3.
- Метамышьяковая кислота HAsO3.
- Ортомышьяковая кислота H3AsO4.
- Пиромышьяковая кислота H4As2O7.

Что такое триоксид мышьяка?
Мышьяк образует два оксида, из которых As2О3 имеет название триоксид. Это вещество, которое часто используется для лечения, но это не совсем безобидный химикат. Это неорганическое соединение, которое является основным источником органоарсенических соединений (соединений, содержащих химическую связь c углеродом) и многих других. Многие применения As2О3 являются спорными из-за токсичной природы элемента. Торговым названием этого соединения является Trisenox.
Общие сведения о триоксиде
Химическая формула триоксида мышьяка имеет следующий вид As2О3. Молекулярная масса этого соединения составляет 197,841 г/моль. Существует много способов получения этого оксида. Одним из них них является обжиг сульфидной руды. Химическая реакция происходит следующим образом:
2As2О3 + 9O2 → 2As2О3 + 6SO2
Большинство оксидов может быть получено в качестве побочного продукта переработки других руд. Арсенопирит является общей примесью в золоте и меди, и он высвобождает триоксид мышьяка при нагревании в присутствии воздуха. Это может привести к серьезному отравлению.

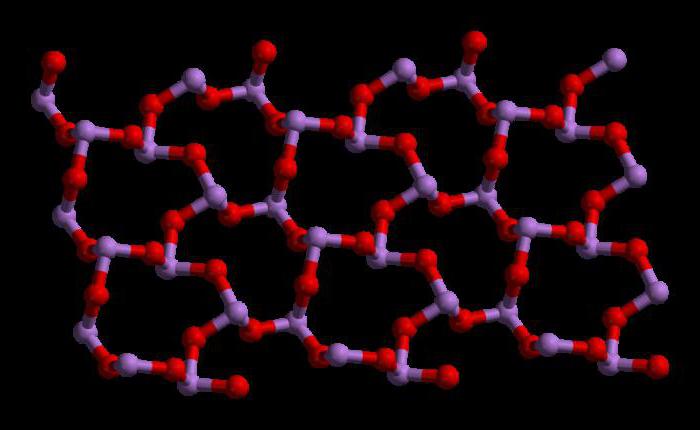
Структура триоксида мышьяка
Триоксид мышьяка имеет формулу As4O6 в жидкой и газовой фазах (ниже 800°C). В этих фазах он является изоструктурным с фосфоровым триоксидом (P4O6). Но при температуре выше 800°C As4O6 разрушается до молекулярного As2O3. В этой фазе он является изоструктурным с триоксидом диизотрона (N2O3). В своем твердом состоянии это соединение показывает полиморфную способность (способность существовать в двух или более формах кристаллической структуры).
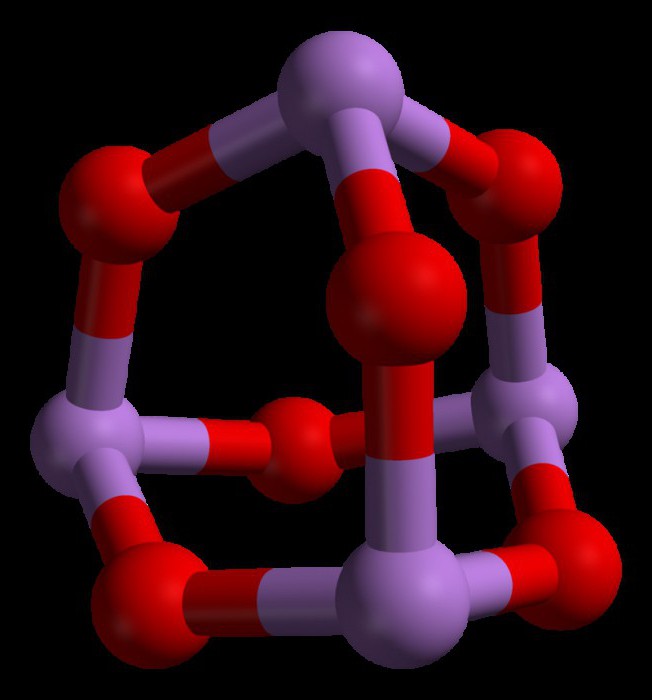
Свойства триоксида мышьяка
Некоторые из основных свойств триоксида мышьяка заключаются в следующем:
- Растворы триоксида образуют слабые кислоты с водой. Это связано с тем, что соединение представляет собой амфотерный оксид мышьяка.
- Он растворим в щелочных растворах и дает арсенаты.
- Триоксид мышьяка обладает высокой растворимостью в соляной кислоте (HCl) и, наконец, дает трихлорид мышьяка и концентрированную кислоту.
- Он дает пентаоксид (As2O5) в присутствии сильных окислителей, таких как пероксид водорода, озон и азотная кислота.
- Он почти нерастворим в органических растворителях.
- Он выглядит как белое твердое тело в нормальном физическом состоянии.
- Он имеет температуру плавления 312,2°C и температуру кипения 465°C.
- Плотность этого вещества составляет 4,15 г/см3.
Применение триоксида мышьяка в медицине
Это химическое вещество относится к классу противоопухолевых средств и применяется при лечении рака. Токсичность мышьяка хорошо известна. Но триоксид мышьяка является химиотерапевтическим препаратом и используется для лечения определенных видов рака в течение многих лет. Решение, используемое для этой обработки, называется раствором Фаулера. В 1878 году Бостонская городская больница сообщила, что этот раствор может быть эффективным в снижении количества лейкоцитов у человека.
В результате As2O3 был главным образом использован для лечения лейкемии до тех пор, пока его не заменила лучевая терапия. Но после 1930-х годов он постепенно восстановил свою популярность в лечении лейкемии, до тех пор, пока не появилась современная химиотерапия. Этот оксид мышьяка считался лучшим методом лечения хронической миелогенной лейкемии. Даже сегодня это вещество используется для лечения конкретного типа острого промиелоцитарного лейкоза при неудачной ретиноидной или антрациклиновой химиотерапии. Он также используется для лечения хронического миелоидного лейкоза, множественной миеломы, острого миелоидного лейкоза, лимфомы, рака лимфатической системы.

Использование триоксида
Триоксид мышьяка широко используется в производстве бесцветного стекла. Это соединение также полезно в области электроники для создания полупроводников и некоторых сплавов. Он используется и в красках. Триоксид мышьяка может оказаться эффективным средством лечения опухоли головного мозга.
В прошлом это вещество использовалось в стоматологии, но поскольку это высокотоксичное соединение, его применение современными стоматологами было прекращено. Оксид мышьяка (формула As2O3) используется также в качестве консерванта для древесины, но такие материалы запрещены во многих частях мира. В сочетании с ацетатом меди трехокись мышьяка дает яркий пигмент зеленого цвета.
Высокотоксичное вещество
Сам по себе триоксид обладает высоким уровнем токсичности. Поэтому всегда необходимо принять необходимые меры предосторожности, прежде чем его использовать. Он может быть очень опасным в следующих случаях:
- Прием пищи. Если As2O3 случайно попадает в пищеварительный тракт, нужно немедленно обратитесь к врачу. Не рекомендуется пытаться вызвать рвоту, прежде чем обращаться за медицинской помощью. Нужно убрать любую плотную одежду, снять галстук, расстегнуть воротник, пояс и т. д.
- Контакт с кожей. В случае соприкосновения с любой поверхностью тела стоит немедленно промыть пораженный участок большим количеством воды. Зараженная одежды и обувь должны быть немедленно удалены, и их следует вымыть перед повторным использованием. В случае серьезного контакта с кожей вам следует немедленно обратиться за медицинской помощью. Может быть полезно промывание зараженной области дезинфицирующим мылом и применение антибактериального крема.
- Попадание в глаза. Если As2O3 вступает в контакт с глазами, первое, что нужно сделать, это удалить любые контактные линзы и промывать глаза большим количеством воды в течение 15 минут. Рекомендуется использовать холодную воду. Параллельно с этим кто-то должен вызвать скорую.
- Ингаляция. Люди, которые вдыхали этот газ, должны быть помещены в другое место со свежим воздухом. А также нужно немедленно обратиться за медицинской помощью. Если трудно дышать, следует незамедлительно вводить кислород. Если пострадавший не в состоянии дышать самостоятельно, необходимо сделать искусственное дыхание.
- Это соединение может оказывать ядовитое воздействие на человека. В случае попадания в организм чрезмерного его количества триоксид мышьяка может даже привести к смерти. Защитные очки и перчатки всегда должны использоваться во время работы с As2O3. Работа всегда должна выполняться в хорошо проветриваемом помещении.

Побочные эффекты
Общие побочные эффекты этого вещества включают в себя такие симптомы, как:
- плохой аппетит;
- рвота;
- тошнота;
- боль в животе;
- запор;
- головная боль;
- усталость;
- головокружение;
- лихорадка;
- проблемы с дыханием;
- высокий уровень лейкоцитов;
- высокий уровень сахара в крови;
- кожная сыпь.
Менее распространенные побочные эффекты включают в себя:
- сухость во рту;
- сбивчивое дыхание;
- боль в груди;
- низкий уровень лейкоцитов;
- мышечную и костную боль;
- опухание лица и глаз;
- понос;
- тремор;
- низкий уровень сахара в крови;
- низкий уровень кислорода в крови.
Редкие побочные эффекты As2O3:
- нерегулярное сердцебиение (это может даже привести к смерти);
- увеличение веса;
- обморок;
- рассеянность;
- кома;
- распухший живот;
- потемнение кожи.
Опасные для жизни симптомы воздействия триоксида мышьяка - это увеличение веса, лихорадка, сложность дыхания, одышка, грудная боль, кашель.
Триоксид мышьяка является высокотоксичным веществом, которое может даже привести к гибели человека. Тем не менее, он имеет свою полезность в медицинской области. Всегда должны приниматься меры предосторожности.
Химические реакции
Триоксид мышьяка представляет собой амфотерный высший оксид мышьяка, и его водные растворы являются слабокислотными. Таким образом, он легко растворяется в щелочных растворах для получения арсенатов. Он менее растворим в кислотах, за исключением соляной.
Только с сильными окислителями, такими как озон, перекись водорода и азотная кислота, из него образуется пента-оксид мышьяка с +5 степенью кислотности As2O5. Что касается устойчивости к окислению, триоксид мышьяка отличается от триоксида фосфора, который легко сгорает до пятиокиси фосфора. Редукция дает элементный мышьяк или арсин (AsH3).

Пентаоксид мышьяка
Химической формулой пентаоксида является As2O5. Его молярная масса составляет 229,8402 г/моль. Это белый гигроскопичный порошок с плотностью 4,32 г/см3. Температура плавления достигает 315°C, при которой он начинает разлагаться. Вещество имеет хорошую растворимость в воде и спирте. Свойства оксида мышьяка делают его очень токсичным и опасным для окружающей среды. Это неорганическое соединение, которое является менее распространенным, высокотоксичными и, следовательно, находит лишь ограниченное коммерческое применение, в отличие от высшего оксида мышьяка (формула As2O3).
Мышьяк известен в первую очередь как яд и канцероген. Его триоксид - это водорастворимый порошок, который производит бесцветный, безвкусный и без запаха раствор. Это был популярный способ убийства в средние века. Его использование продолжается и сегодня, но уже в мирных целях и в небольшом количестве.


























