Рутений - наиболее легкий и наименее "благородный" из всех металлов платиновой группы. Является едва ли не самым "многовалентным" элементом (известно девять валентных состояний). Несмотря на более чем полувековую историю изучения, он и сегодня перед современными химиками ставит немало вопросов и проблем. Так что же представляет собой рутений как химический элемент? Для начала - небольшой экскурс в историю.
Загадочная и богатая
Название и история открытия рутения неразрывно связаны с Россией. В самом начале XΙX века мировую общественность взволновало и обеспокоило известие о том, что в Российской империи обнаружены богатейшие залежи платины. Ходили слухи, что на Урале добычу этого драгоценного металла можно было вести обыкновенной лопатой. Факт открытия богатых месторождений был вскоре подтвержден тем, что министр финансов России Е. Ф. Канкрин направил на Петербургский Монетный двор высочайший указ о чеканке монет из платины. В последующие годы было запущено в оборот около полутора миллионов монет (3,6 и 12 руб.) для производства которых затрачено 20 тонн драгоценного металла.

"Открытие" Озанна
Изучением состава уральской драгоценной руды занялся профессор Дерптско-Юрьевского (ныне Тартусского) университета Готфрид Озанн. Он пришел к выводу, что платине сопутствуют три неизвестных металла - полуран, полином и рутений - названия которым были даны самим Озанном. Кстати, третий он назвал в честь России (от латинского Ruthenia).
Коллеги Озанна во всей Европе, во главе с авторитетнейшим шведским химиком Йенсом Берцелиусом, очень критично отнеслись к сообщению профессора. В попытке оправдаться ученый повторил серию своих экспериментов, но прежних результатов достигнуть не удалось.
Спустя два десятилетия работами Озанна заинтересовался профессор химии Карл Карлович Клаусс (Казанский университет). Он добился разрешения министра финансов получить в лаборатории Монетного двора несколько фунтов остатков производства монет для проведения повторных исследований.
Казанский химический элемент рутений
Русский академик А. Е. Арбузов отмечал в своих трудах, что для открытия нового элемента в те времена химику требовались чрезвычайное трудолюбие и настойчивость, наблюдательность и проницательность, а самое главное - тонкое экспериментальное чутье. Все вышеперечисленные качества в самой высокой степени были присущи молодому Карлу Клауссу.
Исследования ученого имели и практическое значение - дополнительное извлечение чистой платины из остатков руды. Разработав собственный план эксперимента, Клаусс сплавил рудный материал с селитрой и извлек растворимые элементы: осмий, иридий, палладий. Нерастворимую часть подверг воздействию смеси концентрированных кислот ("царской водки") и перегонке. В осадке гидроокиси железа он обнаружил наличие неизвестного металла и выделил его сначала в виде сульфида, а затем - и в чистом (около 6 граммов). Профессор сохранил за элементом название, предложенное Озанном, - рутений.
Открыть и доказать
Но как оказалось, история открытия химического элемента рутения только начиналась. После опубликования в 1844 году результатов исследования на Клаусса обрушился град критики. Выводы неизвестного казанского ученого были скептически восприняты крупнейшими химиками мира. Даже отправка образца нового элемента Берцелиусу не спасла ситуацию. По мнению шведского мэтра, рутений Клаусса являлся лишь "пробой нечистого иридия".
Только выдающиеся качества Карла Карловича как химика-аналитика и экспериментатора и серия дополнительных исследований позволили доказать ученому свою правоту. В 1846 году открытие получило официальное признание и подтверждение. За проведенную работу Клаусс был удостоен Демидовской премии Российской академии наук в размере 10 тыс. рублей. Благодаря таланту и настойчивости казанского профессора ряды платиноидов пополнил рутений - первый элемент, открытый в России (и на сегодняшний день, к сожалению отечественной химической школы, единственный).
Дальнейшие исследования
Основной проблемой изучения химических и физических свойств рутения является крайне ограниченное содержание этого металла в земной коре. Например, в отходах платинового производства (рабочем материале Клаусса) его содержание - около 1 %. Большинство ученых-химиков признают рутений крайне неблагоприятным веществом для изучения. Обилие тупиковых ситуаций часто заставляет исследователей сворачивать или приостанавливать свои работы.
Всю жизнь посвятил изучению свойств "неудобного" металла и его соединений советский ученый С. М. Старостин. Главным результатом деятельности химика являются выводы о свойствах нитрозокомплексов рутения и связанных с ними трудностях отделения чистого металла от сопутствующих урана и плутония. Что же представляет собой рутений, как химический элемент?

Физические свойства
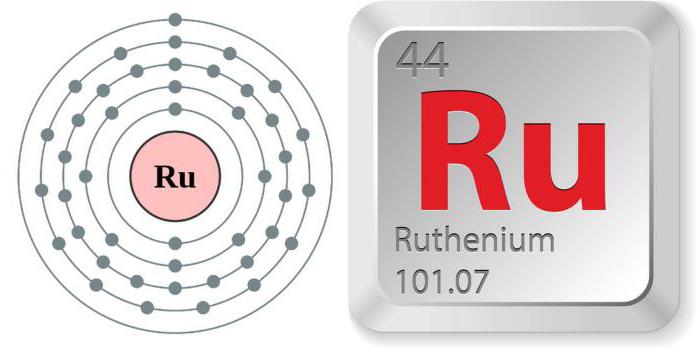
Рутений - металл, цвет которого, в зависимости от способа получения, находится в диапазоне от серо-голубоватого до серебристо-белого. Некоторые физические характеристики химического элемента рутения позволяют считать его уникальным веществом. Наряду с высокой хрупкостью (кристаллы даже вручную легко растираются в порошок), рутений обладает чрезвычайной твердостью - 6,5 по десятибалльной минералогической шкале твердости (шкала Мооса). Едва ли не самый легкий из металлов платиновой группы. Плотность - 12,45г/см3. Очень тугоплавок - температура перехода в жидкое состояние - 2334 °С. При плавлении в электрической дуге наблюдается одновременное испарение металла. При высокотемпературном прокаливании на открытом воздухе элемент "улетучивается" в виде четырехокиси.
Рутений причисляют к группе сверхпроводников. Нулевое сопротивление металл демонстрирует при охлаждении до 0,47 К. Это свойство имеет огромное значение с научной и практической точек зрения. Как платиноид рутений - очень интересный драгоценный металл.
Элемент Ru
Свойства "казанского" металла во многом типичны для представителей VΙΙΙ (платиновой) группы. Рутений - химический элемент периодической таблицы с атомным номером 44, отличающийся высокой инертностью. Имеет 7 стабильных природных и 20 искусственных изотопов с массовыми числами от 92 до 113.
При нормальной температуре не подвержен окислению и коррозии, воздействию кислот и щелочей. При нагреве свыше 400 °С вступает в реакцию с хлором, при 930 °С - с кислородом. С некоторыми металлами химический элемент рутений образует устойчивые сплавы, называемые интерметаллидами.
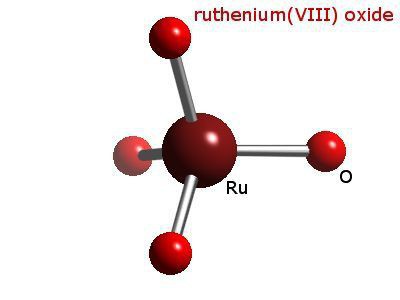
В многочисленных соединениях проявляет валентность от нуля до восьми. К наиболее важным относят двуокись и четырехокись рутения, сульфид RuS2 и фторид RuF5.
В чистом металлическом виде обладает свойствами катализатора с высокой избирательной способностью, что позволяет его использовать для синтеза самых различных органических и неорганических веществ. Служит лучшим сорбентом для водорода.
Распространение в природе
Химический элемент рутений характеризуется чрезвычайной редкостью и рассеянностью в природе. В естественной среде он образует единственный известный минерал - лаурит. Это твердое вещество в виде небольших октаэдров железно-черного цвета. Самое богатое и известное месторождение находится на платиновых россыпях острова Борнео (Калимантан). В России ведутся разработки на Среднем и Южном Урале, на Кольском полуострове, в Красноярском и Хабаровском краях.
Во всех остальных природных соединениях количество рутения не превышает 0,1 %. Следы металла обнаружены в некоторых медно-никелевых рудах и кислых магматических породах. Способностью концентрировать и накапливать рутений облают некоторые растения, среди которых выделяются представители семейства бобовых.
Общее содержание элемента в земной коре, по мнению специалистов, не превышает 5 000 тонн.

Промышленное получение
Элемент рутений считается благородным, и основным источником металла являются отвальные породы производства платины. Безусловным лидером по добыче рутения (как и платины) выступает Южно-Африканская Республика. Разработку и производство этого металла осуществляют также Россия, Канада и Зимбабве. Кстати, последняя страна занимает второе место в мире по разведанным запасам платиноидов.
Количество поставляемого на рынок рутения колеблется от 17 до 20 тонн в год. Производственный цикл получения элемента длится около 6 недель и представляет собой непрерывную цепь следующих друг за другом термохимических реакций.
Разработана технология получения рутения нейтронным облучением изотопов радиоактивного технеция. Но необходимо отметить, что выделение чистого и устойчивого металла, ввиду его химических свойств, непредсказуемости и недостаточной изученности, остается по-прежнему несбыточной мечтой.
Области применения
Хотя все свойства благородного металла у рутения присутствуют в полной мере, широкого распространения в ювелирной индустрии элемент не получил. Его используют лишь для укрепления сплавов и придания дорогим украшениям большей прочности.
По количеству потребляемого рутения секторы промышленности расположились в следующем порядке:
- Электронный.
- Электрохимический.
- Химический.
Очень востребованы каталитические свойства элемента. Его применяют при синтезе синильной и азотной кислот, при получении предельных углеводородов, глицерина и полимеризации этилена. В металлургической промышленности добавки рутения используют для увеличения антикоррозийных свойств, придания сплавам прочности, химической и механической стойкости. Радиоактивные изотопы рутения нередко помогают ученым при проведении научных исследований.
Нашли применение и многие соединения элемента в качестве хороших окислителей и красителей. В частности, хлориды используют для усиления люминесценции.

Биологическое значение
Рутений обладает способностью накапливаться в клетках живых тканей, главным образом - мышечных (единственный из металлов платиновой группы). Может провоцировать развитие аллергических реакций, оказывать негативное воздействие на слизистую оболочку глаз и верхнего дыхательного тракта.
В медицине благородный металл используют как средство для распознавания пораженных тканей. Лекарственные препараты на его основе применяют для лечения туберкулеза и различных инфекций, поражающих кожные покровы человека. По этой причине весьма перспективным выглядит использование способности рутения образовывать прочные нитрозокомплексы в борьбе с заболеваниями, связанными с избыточной концентрацией нитратов в организме человека (гипертонии, артрита, септического шока и эпилепсии).
Кто виноват?
Совсем недавно ученые Западной Европы всерьез обеспокоили общественность сообщением, что над континентом растет содержание радиоактивного изотопа рутения Ru106. Самообразование его в атмосфере специалисты полностью исключают. Как и аварийный выброс с АЭС, так как тогда в воздухе обязательно присутствовали бы радионуклиды цезия и йода, что не подтверждается экспериментальными данными. Воздействие этого изотопа на организм человека, как и всякого радиоактивного элемента, ведет к облучению тканей и органов, развитию онкологических заболеваний. Возможные источники загрязнения, по версии западных СМИ, расположены на территории России, Украины или Казахстана.
В ответ представитель Департамента коммуникаций Росатома заявил, что все предприятия госкорпорации работали и работают в штатных режимах. Международное агентство по атомной энергетике (МАГАТЭ) в своем заключении, основываясь на данных собственного мониторинга, назвало все обвинения в адрес Российской Федерации беспочвенными.


























