Рассмотрим функции негистоновых белков, их значение для организма. Данная тема представляет особый интерес, заслуживает детального изучения.
Главные белки хроматина
Гистоновые и негистоновые белки непосредственно связаны с ДНК. Ее роль в составе интерфазных и митотических хромосом довольно велика - хранение и распространение генетической информации.
При осуществлении подобных функций необходимо обладать четкой структурной базой, позволяющей располагать длинные молекулы ДНК в четком порядке. Подобное действие позволяет контролировать периодичность протекания синтеза РНК, редупликации ДНК.
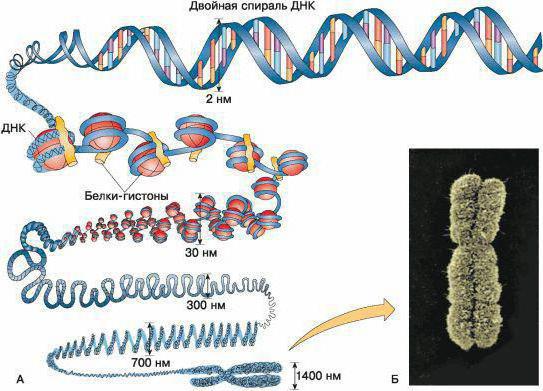
Ее концентрация в интерфазном ядре составляет 100 мг/мл. На одно ядро млекопитающих приходится примерно 2 м ДНК, локализуемой в сферическом ядре диаметром порядка 10 мкм.
Группы белков
Несмотря на многообразие, принято выделять две группы. Функции гистоновых и негистоновых белков имеют определенные отличия. Около 80 процентов всех белков хроматина составляют гистоны. Они взаимодействуют с ДНК за счет ионных и солевых связей.
Несмотря на значительное количество, гистоны и негистоновые белки хроматина представлены несущественным разнообразием белков, в эукариотических клетках содержится порядка пяти-семи типов молекул гистона.
Негистоновые белки в хромосомах в основном специфичны. Они взаимодействуют только с определенными структурами молекул ДНК.
Особенности гистонов
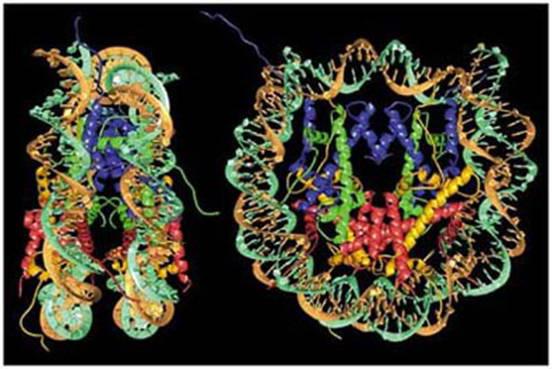
Каковы функции гистоновых и негистоновых белков в хромосоме? Гистоны связываются в виде молекулярного комплекса с ДНК, они являются субъединицами такой системы.
Гистоны являются белками, характерными лишь для хроматина. Они имеют определенные качества, позволяющие им выполнять специфические функции в организмах. Это щелочные или основные белки, характеризующиеся достаточно высоким содержанием аргинина и лизина. Благодаря положительным зарядам на аминогруппах обусловливается электростатическая или солевая связь с противоположными зарядами на фосфатных структурах ДНК.
Такая связь является довольно лабильной, она легко разрушается, при этом происходит диссоциация на гистоны и ДНК. Хроматин считается сложным нуклеиново-белковым комплексом, внутри которого есть высокополимерные линейные молекулы ДНК, а также значительное количество молекул гистонов.
Свойства
Гистоны являются достаточно небольшими белками по молекулярной массе. Они имеют сходные свойства у всех эукариот и обнаруживаются сходными классами гистонов. К примеру, виды H3 и H4 причисляют к богатым аргинином, так как в их составе достаточное количество данной аминокислоты.
Разновидности гистонов
Такие гистоны считают консервативными, так как последовательность аминокислоты в них сходна даже у отдаленных видов.
H2A и H2B считают белками, в которых умеренное содержание лизина. Разные объекты внутри данных групп имеют некоторые вариации в первичной структуре, а также в последовательности расположения аминокислотных остатков.
Гистон H1 является классом белков, в которых аминокислоты располагаются в сходной последовательности.
У них обнаруживаются существеннее межтканевые и межвидовые вариации. В качестве общего свойства рассматривается значительное количество лизина, в результате чего именно эти белки можно отделять от хроматина в разбавленных солевых растворах.
Гистоны всех классов характеризуются кластерным распределением основных аминокислот: аргинина и лизина на концах молекул.
H1 отличается вариабельным N-концом, осуществляющим взаимосвязь с иными гистонами, а С-конец обогащен лизином, именно он вступает во взаимодействие с ДНК.
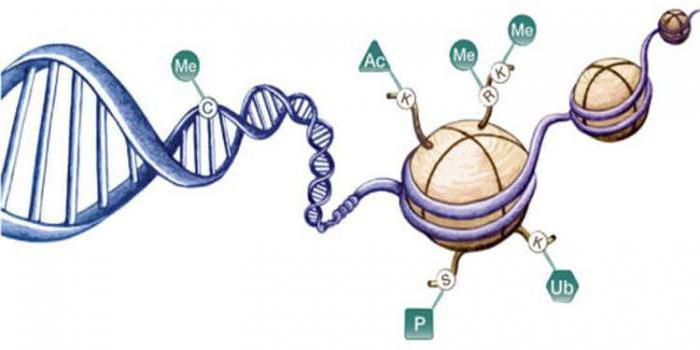
При жизнедеятельности клеток возможны модификации гистонов:
- метилирование;
- ацетилирование.
Подобные процессы приводят к изменению количества положительных зарядов, они являются обратимыми реакциями. При фосфорилировании сериновых остатков появляется избыточный отрицательный заряд. Такие модификации влияют на свойства гистонов, их взаимодействие с ДНК. Например, при ацетилировании гистонов наблюдается активация генов, а дефосфорилирование вызывает деконденсацию и конденсацию хроматина.
Особенности синтеза
Процесс происходит в цитоплазме, далее происходит транспортировка в ядро, связывание с ДНК при ее репликации в S-периоде. После прекращения синтеза клеткой ДНК в течение нескольких минут происходит распад информационных гистоновых РНК, процесс синтеза прекращается.
Подразделение на группы
Выделяют разные виды негистоновых белков. Деление их на пять групп является условным, оно основывается на внутреннем сходстве. Существенное количество отличительных свойств выявлено у высших и низших эукариотических организмов.
К примеру, вместо H1, характерного для тканей низших позвоночных организмов, обнаруживают гистон H5, который содержит большее количество серина и аргинина.
Встречаются и ситуации, связанные с частичным либо полным отсутствием у эукариот гистонных групп.
Функциональные возможности
Подобные белки были найдены в составе бактерий, вирусов, митохондрий. Например, у E. coli в клетке найдены белки, аминокислотный состав которых аналогичен гистонам.
Негистоновые белки хроматина выполняют важные функции в живых организмах. До выявления нуклеосом использовали две гипотезы, касающиеся функционального значения, регуляторной, структурной роли таких белков.
Удалось обнаружить, что при добавлении к выделенному хроматину РНК-полимеразы получается матрица для процесса транскрипции. Но активность его оценивается только в 10 процентов от аналогичного показателя для чистой ДНК. Она возрастает при удалении групп гистонов, а при их отсутствии составляет максимальную величину.
Это свидетельствует о том, что суммарное содержание гистонов позволяет контролировать процесс транскрипции. Качественное и количественно изменение гистонов оказывает влияние на активность хроматина, степень его компактности.
Не до конца изучен вопрос, касающийся специфичности регуляторных характеристик гистонов во время синтеза специфичных и-РНК в разных клетках.
При постепенном добавлении фракции гистонов к растворам, содержащим чистую ДНК, наблюдается выпадение осадка в виде комплекса ДНП. При выведении из раствора хроматина гистонов происходит полный переход в растворимое основание.
Функции негистоновых белков не ограничиваются построением молекул, они намного сложнее и многограннее.
Структурное значение нуклеосом
В первых электромикроскопических и биохимических работах было доказано, что в препаратах ДПН есть нитчатые структуры, диаметр которых находится в интервале 5-50 нм. По мере совершенствования представлений о строении белковых молекул удалось выяснить, что существует прямая зависимость между диаметром фибрилла хроматина и способом выделения препарата.
На тонких срезах митотических хромосом и интерфазных ядер после выявления глутаровым альдегидом были обнаружены хроматированные фибриллы, толщина которых составляет 30 нм.
Аналогичными размерами обладают фибриллы хроматина в случае физической фиксации их ядер: при замораживании, скалывании, взятии реплик с подобных препаратов.
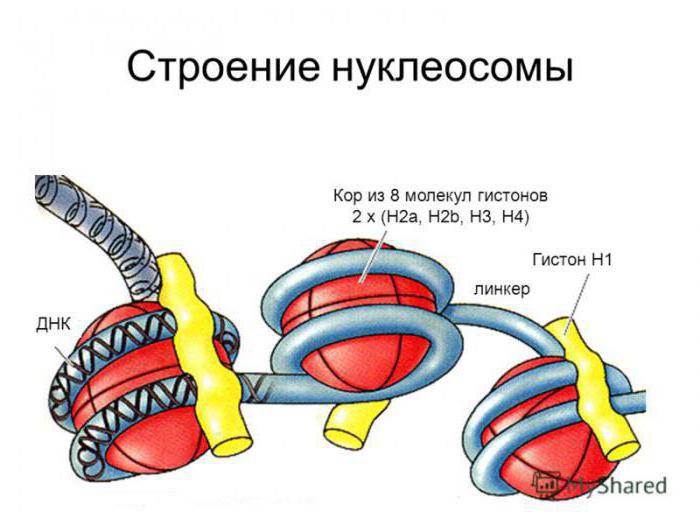
Негистоновые белки хроматина были открыты двумя различными способами нуклеосом-частиц хроматина.
Исследования
При осаждении препаратов хроматина на подложку для электронной микроскопии в щелочных условиях при несущественной ионной силе получаются нити хроматина, похожие на бусы. Их размер не превышает 10 нм, а глобулы связаны между собой отрезками ДНК, длина которых не превышает 20 нм. В ходе наблюдений удалось установить связь между структурой ДНК и продуктами распада.
Интересные сведения
Негистоновые белки составляют порядка двадцати процентов белков хроматина. Они являются белками (кроме тех, что выделяются хромосомами). Негистоновые белки - это комбинированная группа белков, которые между собой отличаются не только по свойствам, но и по функциональной важности.
Большая часть их относится к белкам ядерного матрикса, которые обнаруживаются и в составе интерфазных ядер, и в митотических хромосомах.
Негистоновые белки могут включать порядка 450 индивидуальных полимеров, имеющих различную молекулярную массу. Некоторые из них растворимы в воде, есть и такие, которые растворимы в кислых растворах. Из-за непрочности связи с хроматином протекающей диссоциации при наличии денатурирующих агентов возникают существенные проблемы с классификацией и описанием данных белковых молекул.
Негистоновые белки - это регуляторные полимеры, стимулирующие транскрипцию. Есть и ингибиторы данного процесса, которые связываются в специфической последовательности на ДНК.
К негистоновым белкам могут относиться и ферменты, принимающие участие в метаболизме нуклеиновых кислот: метилазы РНК и ДНК, ДНКазы, полимеразы, белки хроматина.
Среда множества подобных полимерных соединений максимально изученными считают негистоновые белки, обладающие высокой подвижностью. Для них свойственна неплохая электрофоретическая подвижность, экстрагирование в растворе поваренной соли.
HMG-белки представлены в четырех видах:
- HMG-2 (м.в. = 26 000),
- HMG-1 (м.в. = 25 500),
- HMG-17 (м.в. = 9247),
- HMG-14 (м.в. = 100 000).
В живой клетке таких структур содержится не больше 5 % от суммарного количества гистонов. Они особенно распространены в активном хроматине.
Белки HMG-2 и HMG-1 не включены в состав нуклеосом, они связываются только с линкерными фрагментами ДНК.
Белки HMG-14 и HMG-17 способны связываться с сердцеподобными полимерами нуклеосом, в результате чего происходит изменение уровня сборки фибрилл ДНП, они будут более доступны для реакции с РНК-полимеразой. В подобной ситуации HMG-белки выполняют роль регуляторов транскрипционной активности. Удалось выявить, что фракция хроматина, которая обладает повышенной чувствительностью к ДНКазе I, насыщена HMG-белками.
Заключение
Третьим уровнем структурной организации хроматина являются петлевые домены ДНК. В ходе исследований было установлено: только при расшифровке принципа хромосомных элементарных компонентов сложно получить полное представление о хромосомах в митозе, в интерфазе.
Уплотнение ДНК в 40 раз получают благодаря максимальной спирализации. Этого недостаточно для того, чтобы получить реальное представление о размерах и характеристиках хромосом. Можно сделать закономерный вывод о том, что должны быть еще более высокие уровни сборки ДНК, с помощью которых можно было бы однозначно дать общую характеристику хромосомам.
Ученым удалось обнаружить подобные уровни организации хроматина в результате его искусственной деконденсации. В подобной ситуации специфические белки будут связываться с некоторыми участками ДНК, имеющими в местах объединения домены.
Принцип петлевой упаковки ДНК был обнаружен и у эукариотических клеток.
Например, если провести обработку выделенных ядер раствором поваренной соли, будет сохранена целостность ядра. Подобная структура стала называться нуклеотидом. Его периферия включает в себя значительное количество замкнутых петель ДНК, средний размер которых составляет 60 т.п.н.
При препаративном выделении хромомеров, последующем экстрагировании гистонов из них под электронным микроскопом будут видны петлистые розеткообразные структуры. Число петель в одной розетке составляет от 15 до 80, суммарная длина ДНК доходит дл 50 мкм.
Представления о строении и основных функциональных характеристиках белковых молекул, полученные в ходе экспериментальной деятельности, позволяют ученым вести разработку лекарственных препаратов, создавать инновационные методики эффективной борьбы с генетическими заболеваниями.


























