Анилин — это органическое соединение, содержащее ароматическое ядро и аминогруппу, соединенную с ним. Его также иногда называют фениламином или аминобензолом. Представляет собой маслянистую жидкость, не имеющую цвета, но с характерным запахом. Сильно ядовит.
Получение
Анилин — очень полезное промежуточное вещество, поэтому производится он в относительно больших масштабах. Промышленный синтез начинается с бензола. Его нитруют при температуре 60 °C смесью концентрированных серной и азотной кислот. Далее полученный нитробензол восстанавливают водородом при температуре около 250 °C, используя катализаторы. Также может применяться повышенное давление.
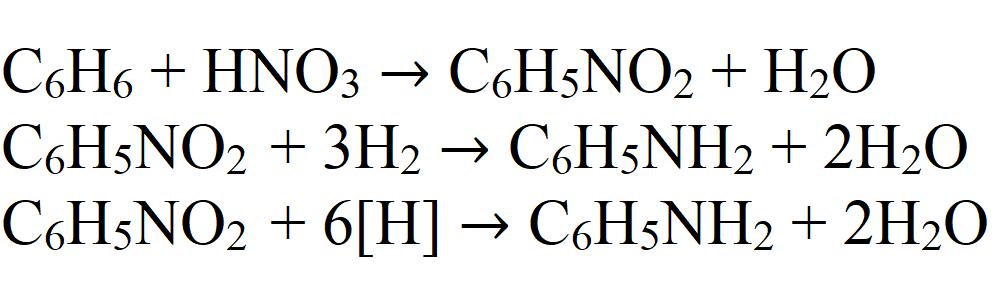
В лаборатории восстановление может производится водородом в момент его выделения. Для этого в реакционной смеси проводят взаимодействие металлического цинка или железа с кислотой. Полученный атомарный водород вступает во взаимодействие с нитробензолом.
Получать анилин можно в одну стадию, если проводить взаимодействие бензола со смесью азида натрия и хлорида алюминия. Реакция длится 12 часов. Выход такой реакции составляет 63 %.
Физические свойства
Как уже было отмечено выше, анилин — это бесцветная маслянистая жидкость. При температуре -5,9 °C он замерзает. Кипит при 184,4 °C. Плотность почти как у воды (1,02 г/см3). Анилин растворим в воде, хотя довольно слабо. Зато он смешивается в любых соотношениях с различными органическими растворителями: бензолом, толуолом, ацетоном, диэтиловым эфиром, этанолом и многими другими.
Химические свойства
Химические свойства анилина довольно разнообразны. Например, он проявляет как кислотные, так и основные свойства. Последние обусловлены тем, что аминогруппа может присоединять к себе ион водорода (протон). Отсюда и название этого процесса — протонирование. Благодаря этому анилин может взаимодействовать с кислотами, образуя соли:
C6H5NH2 + HCl → [C6H5NH3]+Cl-
Кислотные свойства объясняются тем, что атомы водорода в аминогруппе легко отщепляются и замещаются другими атомами. Так, анилин может взаимодействовать со щелочными металлами. Реакция с калием идет без катализаторов, с натрием необходимо присутствие катализаторов: меди, никеля, кобальта или солей этих металлов. Идти эта реакция может и с кальцием, но в этом случае необходимо нагревание до 200 °C.
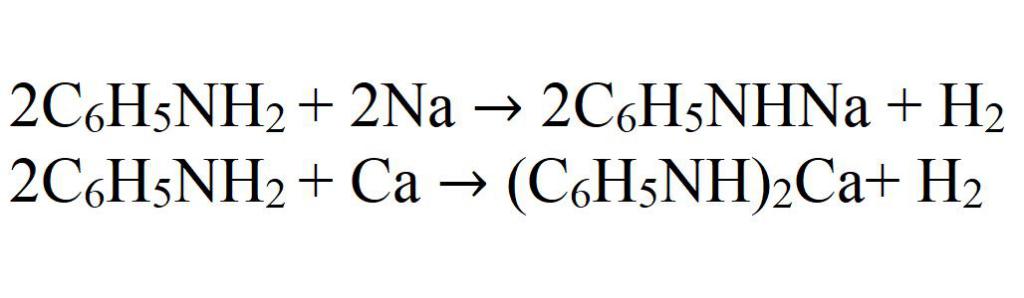
Замещается водород и радикалами. Это происходит при взаимодействии анилина со спиртами. Реакция проводится в кислой среде, так как необходимо протонирование аминогруппы. Температура реакционной смеси должна поддерживаться около 220 °C. Иногда применяется повышенное давление. Конечный продукт содержит моно-, ди- и тризамещенные производные анилина. Поэтому для получения чистого вещества необходимо использовать очистку, например перегонку.
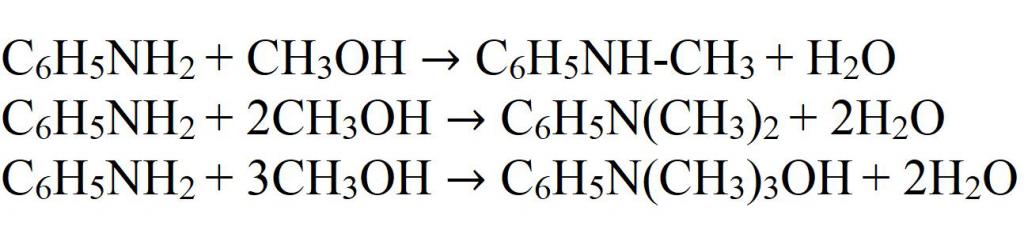
Алкилирование можно также проводить, используя алкилгалогениды. Здесь также может быть получены несколько продуктов.
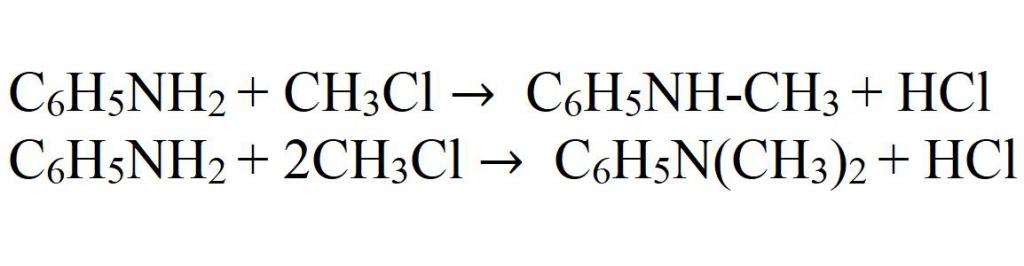
Анилин может вступать в реакции и по ароматическому ядру. Обычно это реакции электрофильного замещения (нитрование, сульфирование, алкилирование, ацилирование). Аминогруппа активирует бензольное ядро, поэтому новые группы встают в пара-положение. Галогенирование происходит очень легко. В данном случае замещаются все атомы водорода в ядре.
Как видно из уравнений реакций, химические свойства анилина довольно разнообразные. Здесь указаны далеко не все.
Применение
Из-за своих физических и химических свойств, анилин в чистом виде применяется только в лабораториях, как реагент или органический растворитель. В промышленности весь анилин уходит на синтез более сложных и полезных соединений. Например, фосфат анилина применяется как ингибитор (замедлитель) коррозии углеродистых сталей.
Большая доля анилина идет на производство полиизоцианатов, из которых, в свою очередь, получают полиуретаны. Это органический полимер, который используют во многих отраслях промышленности для изготовления эластичных форм, защитных покрытий, лаков, герметиков.
7 % анилина применяется в качестве добавки для полимеров. Это может быть как чистый анилин, так и соединения, полученные из него. Они оказывают роль инициаторов, стабилизаторов, пластификаторов, порообразователей, вулканизаторов или ускорителей полимеризации. Такое разнообразие достигается благодаря специфичным химическим свойствам анилина.
Азотсодержащие органические вещества часто применяют в производстве красителей. Анилин не стал исключением. Из него напрямую синтезируют более 150 различных красителей, еще больше - из его производных. Самые важные из них — это анилиновый черный, пигмент глубоко-черный, нигрозины, индулины и азокрасители.
Токсичность
Анилин — токсичное вещество. Попадая в кровь, он образует соединения, которые вызывают кислородное голодание. Проникать в организм он может также и в виде паров, через кожу или слизистые оболочки. Признаками отравления анилином служат слабость, головокружение, головная боль. При более сильном отравлении возникает тошнота, рвота, а также учащение пульса.
Это вещество оказывает губительное воздействие на нервную систему. При хроническом отравлении может возникать снижение памяти, расстройства сна, а также психические нарушения.
Первая помощь при интоксикациии состоит в том, чтобы убрать источник отравления и омыть пострадавшего теплой водой. Это поможет растворить анилин, который осел на коже пострадавшего. Существуют и специальные антидоты. Их вводят в организм при тяжелых случаях.