В физике понятие "тепло" связано с процессами передачи термической энергии между различными телами. Благодаря этим процессам происходит нагрев и охлаждение тел, а также изменение их агрегатных состояний. Рассмотрим подробнее вопрос, что такое тепло.
Концепция понятия
Что такое тепло? Каждый человек может ответить на этот вопрос с бытовой точки зрения, подразумевая под рассматриваемым понятием ощущения, которые у него возникают при увеличении температуры окружающей среды. В физике же под данным явлением понимают процесс передачи энергии, связанный с изменением интенсивности хаотичного движения молекул и атомов, которые образуют тело.
В общем случае можно сказать, что чем больше температура тела, тем больше в нем запасено внутренней энергии, и тем большее количество тепла оно может отдать другим объектам.
Тепло и температура

Зная ответ на вопрос, что такое тепло, многие могут подумать, что эта концепция аналогична понятию "температура", но это не так. Тепло - это кинетическая энергия, температура же - это мера этой энергии. Так, процесс передачи тепла зависит от массы вещества, от количества частиц, которые его составляют, а также от типа этих частиц и средней скорости их движения. В свою очередь температура зависит только от последнего из перечисленных параметров.
Отличие между теплом и температурой легко понять, если провести простой эксперимент: необходимо в два сосуда налить воду так, чтобы один сосуд был полный, а другой наполнен лишь наполовину. Поставив оба сосуда на огонь, можно наблюдать, что первым начнет кипеть тот, в котором меньше воды. Чтобы закипел второй сосуд, ему понадобиться еще некоторое количество тепла от огня. Когда оба сосуда будут кипеть, то можно измерить их температуру, она окажется одинаковой (100 oC), но при этом для полного сосуда понадобилось больше тепла, чтобы вода в нем закипела.
Единицы измерения тепла

Согласно определению тепла в физике, можно догадаться, что оно измеряется в тех же единицах, что и энергия или работа, то есть в джоулях (Дж). Помимо основной единицы измерения тепла, в быту часто можно слышать о калориях (ккал). Под этим понятием понимают количество теплоты, которое нужно передать одному грамму воды, чтобы ее температура поднялась на 1 кельвин (К). Одна калория равна 4,184 Дж. Также можно слышать о больших и малых калориях, которые являются 1 ккал и 1 кал, соответственно.
Понятие теплоемкости
Зная, что такое тепло, рассмотрим физическую величину, которая непосредственно его характеризует - теплоемкость. Под данным понятием в физике подразумевают количество теплоты, которое необходимо отдать телу или забрать у него, чтобы его температура изменилась на 1 кельвин (К).
Теплоемкость конкретного тела зависит от 2-х главных факторов:
- от химического состава и агрегатного состояние, в котором представлено тело;
- от его массы.
Чтобы эту характеристику сделать не зависящей от массы объекта, в физике тепла ввели другу величину - удельную теплоемкость, которая определяет количество переданного или взятого тепла данным телом на 1 кг его массы при изменении температуры на 1 К.
Чтобы наглядно показать различие в удельных теплоемкостях для разных веществ, можно для примера взять 1 г воды, 1 г железа и 1 г подсолнечного масла и нагревать их. Быстрее всего температура будет меняться для железного образца, затем для капли масла, и в последнюю очередь для воды.
Отметим, что удельная теплоемкость зависит не только от химического состава вещества, но и от его агрегатного состояния, а также от внешних физических условий, при которых она рассматривается (постоянное давление или постоянный объем).
Главное уравнение процесса передачи тепла
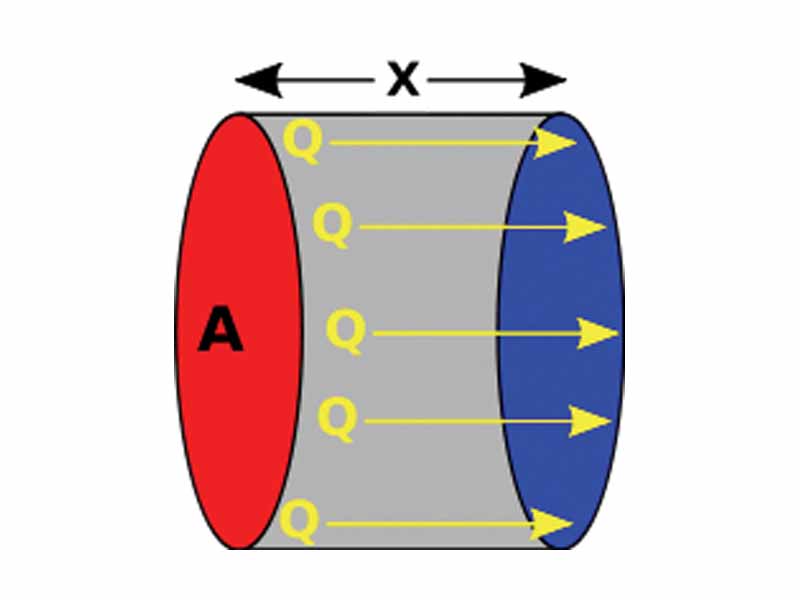
Разобравшись с вопросом, что такое тепло, следует привести основное математическое выражение, которое характеризуется процесс его передачи для абсолютно любых тел в любых агрегатных состояниях. Это выражение имеет вид: Q = c*m*ΔT, где Q - количество переданной (принятой) теплоты, c - удельная теплоемкость рассматриваемого объекта, m - его масса, ΔT - изменение абсолютной температуры, которое определяется как разница температур тела в конце и в начала процесса передачи тепла.
Важно понимать, что приведенная формула будет справедливой всегда, когда во время рассматриваемого процесса объект сохраняет свое агрегатное состояние, то есть остается жидкостью, твердым телом или газом. В противном случае уравнение нельзя использовать.
Изменение агрегатного состояния вещества

Как известно, существует 3 основных агрегатных состояния, в которых может находиться материя:
- газ;
- жидкость;
- твердое тело.
Чтобы произошел переход из одного состояния в другое, необходимо телу сообщить либо отнять у него тепло. Для таких процессов в физике ввели понятия удельных теплот плавления (кристаллизации) и кипения (конденсации). Все эти величины определяют количество тепла, необходимого для изменения агрегатного состояния, которое выделяет или поглощает 1 кг массы тела. Для этих процессов справедливо уравнение: Q = L*m, где L - удельная теплота соответствующего перехода между состояниями вещества.
Ниже приведем основные особенности процессов изменения агрегатного состояния:
- Эти процессы идут при постоянной температуре, например, температуре кипения или плавления.
- Они являются обратимыми. Например, количество тепла, которое поглотило данное тело, чтобы расплавиться, будет точно равно количеству тепла, которое выделиться в окружающую среду, если это тело снова перейдет в твердое состояние.
Термическое равновесие
Это еще один важный вопрос, связанный с концепцией "тепло", который необходимо рассмотреть. Если два тела с разной температурой привести в контакт, то через некоторое время температура во всей системе выровняется и станет одинаковой. Для достижения термического равновесия тело с большей температурой должно отдать тепло в систему, а тело с меньшей температурой должно принять это тепло. Законы физики тепла, описывающие этот процесс, можно выразить в виде комбинации главного уравнения передачи тепла и уравнения, которое определяет изменение агрегатного состояния вещества (если таковое имеется).
Ярким примером процесса самопроизвольного установления термического равновесия является раскаленный железный брус, который брошен в воду. При этом горячее железо будет отдавать воде тепло до тех пор, пока его температура не станет равной температуре жидкости.
Основные способы передачи тепла

Все известные человеку процессы, которые идут с обменом тепловой энергией, происходят тремя различными способами:
- Теплопроводность. Чтобы происходил теплообмен этим способом, необходим контакт двух тел с различной температурой. В зоне контакта на локально-молекулярном уровне происходит передача кинетической энергии от горячего тела к холодному. Скорость этой теплопередачи зависит от способности участвующих тел проводить тепло. Ярким примером теплопроводности является касание человеком металлического стержня.
- Конвекция. Этот процесс требует перемещения вещества, поэтому он наблюдается только в жидкостях и газах. Суть конвекции заключается в следующем: когда газовые или жидкие слои нагреваются, то их плотность уменьшается, поэтому они стремятся подняться вверх. Во время своего подъема в объеме жидкости или газа они переносят тепло. Примером конвекции является процесс закипания воды в чайнике.
- Излучение. Этот процесс передачи тепла происходит за счет испускания нагретым телом электромагнитного излучения различных частот. Солнечный свет - яркий пример излучения.



























