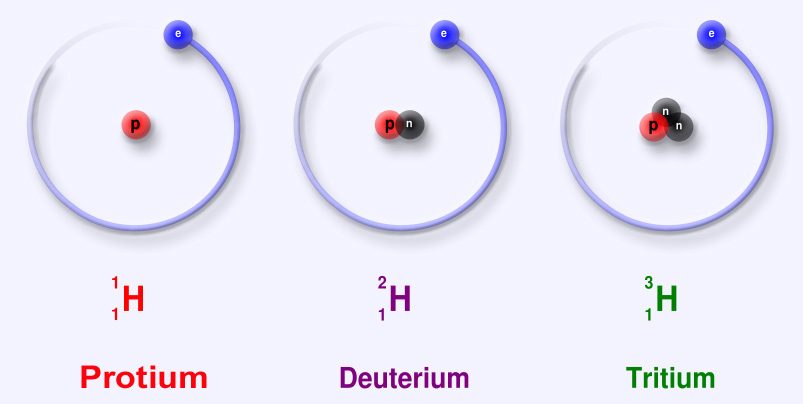
Все элементы имеют атомы в качестве своей основной единицы, а атом содержит три фундаментальные частицы, которые являются отрицательно заряженными электронами, положительно заряженными протонами и нейтронами нейтральных частиц. Количество протонов и нейтронов, присутствующих в ядре, называется массовым числом элементов, а число протонов - атомным номером. Те же самые элементы, атомы которых содержат одинаковое количество протонов, но различное количество нейтронов, называются изотопами. В качестве примера можно взять водород, который имеет три изотопа. Это водород с нулевыми нейтронами, дейтерий, содержащий один нейтрон, и тритий - он содержит два нейтрона. В этой статье речь пойдет об изотопе водорода, который называется дейтерием, известном так же, как тяжелый водород.
Что такое дейтерий?
Дейтерий – это изотоп водорода, который отличается от водорода одним нейтроном. Обычно водород имеет только один протон, а дейтерий - один протон и один нейтрон. Он широко применяется в реакциях деления.
Дейтерий (химический символ D или ²H) является стабильным изотопом водорода, встречающимся в природе в чрезвычайно небольших количествах. Ядро дейтерия, называемое дейтроном, содержит один протон и один нейтрон, тогда как гораздо более распространенное ядро водорода содержит только один протон и не содержит нейтронов. Следовательно, каждый атом дейтерия имеет массу, которая примерно вдвое больше массы обычного атома водорода, и дейтерий также называют тяжелым водородом. Вода, в которой обычные атомы водорода заменены атомами дейтерия, называется тяжелой водой.
Основные характеристики
Изотопная масса дейтерия - 2,014102 ед. Дейтерий имеет стабильный период полураспада, поскольку он является стабильным изотопом.
Избыточная энергия дейтерия составляет 13 135,720 ± 0,001 кэВ. Энергия связывания для ядра дейтерия - 2224,52 ± 0,20 кэВ. Дейтерий соединяется с кислородом с образованием D2O (2Н2О), так же известном, как тяжелая вода. Дейтерий – это не радиоактивный изотоп.
Дейтерий не опасен для здоровья, но может быть использован для создания ядерного оружия. Дейтерий не производится искусственно, так как он естественным образом в большом количестве присутствует в океанской воде и может служить многим поколениям людей. Его извлекают из океана, используя процесс центрифугирования.
Тяжелый водород
Тяжелый водород - это название любого из высших изотопов водорода, таких как дейтерий и тритий. Но чаще оно используется для дейтерия. Его атомная масса составляет около 2, и в его ядре содержится 1 протон и 1 нейтрон. Таким образом, его масса в два раза больше массы нормального водорода. Дополнительный нейтрон в дейтерии делает его тяжелее нормального водорода, поэтому его называют тяжелым водородом.
Тяжелый водород был обнаружен Гарольдом Юри в 1931 году - это открытие было удостоено Нобелевской премии по химии в 1934 году. Юри предсказал разницу между давлением пара молекулярного водорода (H2) и соответствующей молекулы с одним атомом водорода, замененным дейтерием (HD), и, таким образом, возможность разделения этих веществ путем перегонки жидкого водорода. Дейтерий был обнаружен в остатке от перегонки жидкого водорода. Он был приготовлен в чистом виде Г.Н. Льюисом с помощью электролитического метода концентрации. Когда вода электризуется, образуется газообразный водород, который содержит небольшое количество дейтерия, поэтому дейтерий концентрируется в воде. Когда количество воды уменьшается до примерно ста тысячных от ее первоначального объема в результате продолжающегося электролиза, обеспечивается почти чистый оксид дейтерия, известный как тяжелая вода. Этот метод приготовления тяжелой воды был использован во время Второй мировой войны.
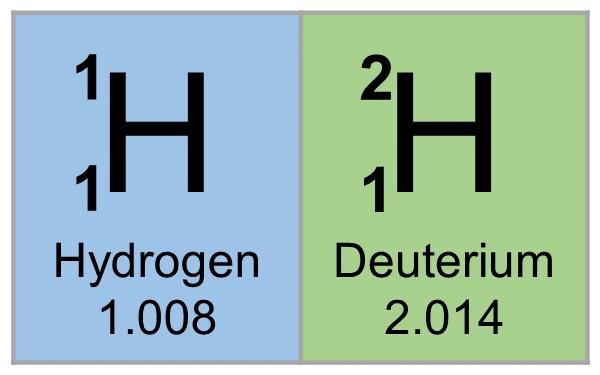
Этимология и химический символ
Название "дейтерий" происходит от греческого слова deuteros, что означает "второй". Это указывает на то, что с атомным ядром, состоящим из двух частиц, дейтерий – это второй изотоп после обычного (или легкого) водорода.
Дейтерий часто обозначается химическим символом D. Как изотоп водорода с массовым числом 2, он также представлен как H. Формула дейтерия - 2Н. Международный союз теоретической и прикладной химии (IUPAC) допускает использование как D, так и H, хотя предпочтительным является H.
Как получить дейтерий из воды?
Традиционный метод концентрирования дейтерия в воде использует изотопный обмен в газообразном сероводороде, хотя в настоящее время разрабатываются более совершенные методы. Разделение различных изотопов водорода также можно проводить с помощью газовой хроматографии и криогенной дистилляции, которые используют различия в физических свойствах для разделения изотопов.
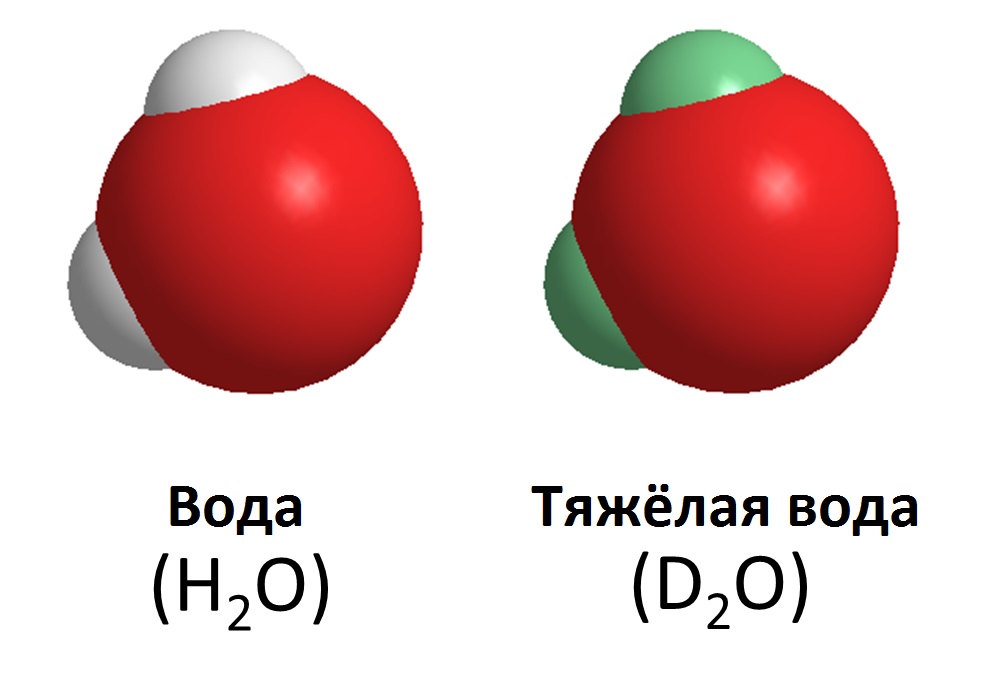
Дейтериевая вода
Вода дейтерия, так же известная, как тяжелая вода, похожа на обычную воду. Она образована комбинацией дейтерия и кислорода и обозначается как 2Н2O. Дейтериевая вода более вязкая, чем обычная. Тяжелая вода плотнее обычной на 10,6%, поэтому лед тяжелой воды тонет в обычной воде. Для некоторых животных дейтериевая вода является токсичной, в то время как другие способны выжить в тяжелой воде, но развиваться в ней они будут медленнее, чем в нормальной. Дейтериевая вода не радиоактивна. Организм человека содержит около 5 граммов дейтерия, и он безвреден. Если тяжелая вода попадает в организм в больших количествах (например, около 50% воды в организме становится тяжелой), это может привести к дисфункции клеток, и в конечном итоге - к смерти.
Отличия тяжелой воды:
- Температура замерзания составляет 3,82 °С.
- Температура кипения составляет 101,4 °С.
- Плотность тяжелой воды составляет 1,1056 г/мл (нормальной воды - 0,9982 г/мл).
- pH тяжелой воды составляет 7,43 (обычной воды - 6,9996).
- Существует небольшая разница во вкусе и запахе простой и тяжелой воды.
Применение дейтерия
Ученые разработали множество вариантов использования для дейтерия и его соединений. Например, дейтерий - это нерадиоактивный изотопный индикатор для изучения химических реакций и метаболических путей. Кроме того, он полезен для изучения макромолекул с помощью рассеивания нейтронов. Дейтерированные растворители (как тяжелая вода) обычно используются в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку эти растворители не влияют на спектры ЯМР исследуемых соединений. Дейтерированные соединения также полезны для фемтосекундной инфракрасной спектроскопии. Дейтерий также является топливом для реакций ядерного синтеза, которые когда-нибудь могут быть использованы для производства электроэнергии в промышленных масштабах.



























