Кислоты – это химические соединения, в состав которых входят атомы водорода, способные замещаться на частицы металлов и кислотный остаток. Они также могут быть определены как вещества, которые могут реагировать с химическим основанием, образуя соль и воду.
Существует два основных типа этих соединений: сильные и слабые. Они также могут быть классифицированы как минеральные и органические кислоты в зависимости от химического состава. Основное различие между ними заключается в том, что первые представляют собой неорганические соединения, состоящие из различных комбинаций химических элементов, тогда как вторые - комбинация из атомов углерода и водорода.
Определение
Минеральная кислота - это вещество, синтезируемое из одного или нескольких неорганических соединений. Оно выделяет ионы водорода в растворе, из которого, в свою очередь, водород может вытесняться металлом с образованием соли. Разные кислоты имеют разные формулы. Например, у серной кислоты - это H2SO4, у азотной - HNO3.
Соли минеральных кислот содержатся внутри живых организмов, растворенные в воде (в виде ионов) или находятся в твердом состоянии (например, соли кальция и фосфора в составе скелета человека и большинства позвоночных животных).
Одна общая характеристика всех кислот состоит в том, что они всегда имеют, по крайней мере, один атом водорода в своей молекуле. Все они участвуют в реакции нейтрализации, реагируя с основаниями и образуя соли и воду. Другие свойства кислот - кислый вкус и способность вызывать изменение цвета некоторых красителей. Типичным примером этого является преобразование колера лакмусовой бумаги с синего на красный.
Минеральные кислоты хорошо растворимы в воде. Они абсолютно не смешиваются с органическими растворителями. Большинство из них очень агрессивно.
Перечень неорганических кислот
К минеральным относятся следующие вещества:
- Соляная кислота - HCl.
- Азотная кислота - HNO3.
- Фосфорная кислота - H3PO4.
- Серная кислота - H2SO4.
- Борная кислота - H3BO3.
- Плавиковая кислота - HF.
- Бромистоводородная кислота - HBr.
- Хлорная кислота - HClO4.
- Иодистоводородная кислота - HI.
Так называемые эталонные кислоты – соляная, серная и азотная - являются наиболее часто используемыми. Далее рассмотрим подробнее.
Соляная кислота
Концентрированное вещество представляет собой водный раствор, содержащий в составе около 38 % хлористого водорода (HCl). Обладает резким запахом, вызывает ожоги органов дыхания и глаз. Соляная кислота не классифицируется как окислитель или восстановитель. Однако при смешивании, например, с гипохлоритом натрия (отбеливателем) или перманганатом калия, она выделяет токсичный газообразный хлор.
Являясь неокисляющей кислотой, HCl растворяет большинство неблагородных металлов, выделяя легковоспламеняющийся газообразный водород.
Азотная кислота (HNO3)
Азотная кислота поставляется в виде концентрированного раствора (68-70 %, 16 М) и в безводной форме (100 %). Это сильный окислитель. Свойства сохраняются, даже если он достаточно разбавлен и находится при комнатной температуре. Это вещество окисляет большинство органических соединений, превращаясь в закись азота. Она может образовывать взрывоопасные смеси практически с любым органическим соединением.
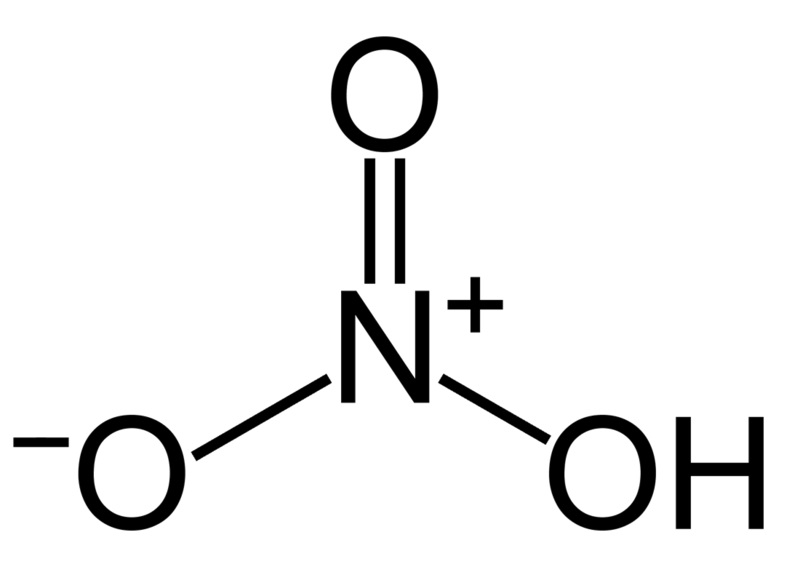
Концентрированная азотная кислота бурно реагирует с органическим материалом, что приводит к выделению газа и потенциальному повышению давления, после чего происходит разрыв сосуда, если емкость не вентилируется надлежащим образом. Реакции окисления с некоторыми органическими растворителями могут образовывать взрывоопасные нитраты.
Азотная кислота вступает во взаимодействие с большинством металлов, выделяя либо газообразный водород, либо оксиды азота в зависимости от концентрации и вида реагента. Она не растворяет золото и платину.
Смешивание азотной и соляной кислоты приведет к образованию коричневых паров, состоящих из токсичных оксидов азота.
Вещество вызывает возникновение желтых пятен на коже.
Серная кислота (H2SO4)
Концентрированное вещество часто поставляется в 98 % растворе (18 М). Это сильный окислитель, гигроскопичный и сильный обезвоживающий агент.
Разбавленное вещество реагирует с металлами подобно другим минеральным кислотам, выделяя газообразный водород. Концентрированное соединение также может растворять некоторые благородные металлы, такие как медь, серебро и ртуть, выделяя диоксид серы (SO2). Свинец и вольфрам не вступают в реакцию с серной кислотой.
Благодаря своей сильной окислительной и дегидратирующей способности она бурно реагирует со многими органическими химическими веществами, что приводит к выделению газа.
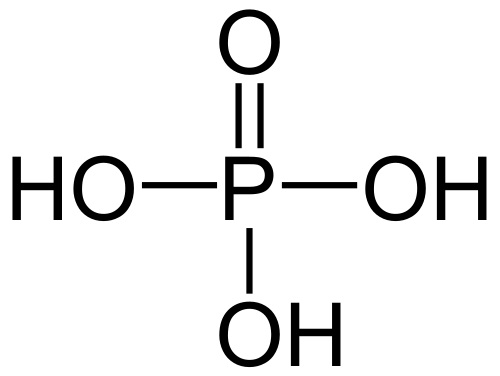
Фосфорная кислота (H3PO4)
Чистая ортофосфорное соединение представляет собой водорастворимое кристаллическое твердое вещество. Кислота, чаще всего продаваемая в виде 85 % водного раствора, является вязкой, нелетучей и не имеет запаха. Она является менее реакционной, чем другие минеральные кислоты, рассмотренные выше.
Растворяясь в воде, вещество делает жидкость вязкой и тягучей.
Использование минеральных кислот
Неорганические кислоты варьируются от кислот с большой силой (серная) до очень слабых (борная). Они имеют тенденцию быть растворимыми в воде и не смешиваться с органическими растворителями.
Минеральные кислоты используются во многих секторах химической промышленности в качестве сырья для синтеза других химических веществ, как органических, так и неорганических. Большое количество их, особенно серная, азотная и соляная, производятся для коммерческого использования на крупных заводах.
Они также широко применяются из-за своих коррозионных свойств. Например, разбавленный раствор соляной кислоты используется для удаления отложений внутри котлов. Этот процесс известен как удаление накипи.

В повседневной жизни серная кислота может использоваться для автомобильных аккумуляторов и очистки поверхностей. Всего несколько десятилетий назад люди регулярно покупали бутылки с этим веществом, чтобы заряжать свои автомобильные аккумуляторы.
Азотная кислота (HNO3) используется в химчистке. Фосфорная кислота (H3РО4) применяется при производстве спичек.
Сходство
Между неорганическими и органическими кислотами существуют характеристики, которые их объединяют в одну группу. Перечень их таков:
- Могут выделять протоны (ионы H).
- Вступают в реакцию с химическими основаниями.
- Имеют сильную и слабую кислотность.
- Окрашивают синюю лакмусовую бумажку в красный цвет.
- Взаимодействие кислот и минеральных веществ.
Различия
Между неорганическими и органическими кислотами стоит выделить следующие расхождения:
- Определение. Минеральные кислоты – это вещества, полученные из неорганических соединений. Органические кислоты – это органические соединения, обладающие кислотными свойствами.
- Происхождение. Большинство минеральных кислот имеют не биологическое происхождение, например, минеральные источники. С органическими соединениями все наоборот.
- Растворимость. Большинство минеральных кислот хорошо растворяются в воде. Органические же соединения плохо смешиваются с жидкостью.
- Кислотность. Большинство минеральных кислот являются сильными. Органические - обычно слабые.
- Химический состав. Минеральные кислоты могут иметь или не иметь атомы углерода в своей структуре. В органических соединениях они присутствуют всегда.
В статье представлены данные о кислотах и их свойствах.


























