Зарядовое число - одна из фундаментальных характеристик атома, определяющая его свойства. Она показывает, сколько протонов в ядре данного атома. Но как же его измерить для разных элементов?
В этой статье мы разберем основные способы определения зарядового числа и расскажем, как с помощью нехитрых экспериментов можно измерить это важное свойство любого химического элемента.
Методы измерения зарядового числа элемента
Существует несколько основных подходов к определению зарядового числа:
- Измерение массового числа и атомной массы
- Рентгеноструктурный анализ
- Определение периода и группы в Периодической системе
- Химические реакции элемента
Рассмотрим каждый из них подробнее.
Измерение массового числа и атомной массы
Один из наиболее точных способов - измерить массовое число атома (суммарное число протонов и нейтронов) и его атомную массу. Разность этих величин как раз и даст зарядовое число, то есть количество протонов.
Для определения массового числа используется масс-спектрометрия - метод, основанный на ионизации атомов образца и последующем разделении их по массе в магнитном поле. Атомная масса измеряется с помощью точных весов.

Рентгеноструктурный анализ
Еще один точный метод, позволяющий напрямую определить заряд ядра атома. Он основан на дифракции рентгеновских лучей на кристаллической решетке вещества.
По углам дифракции можно вычислить расстояния между атомами в решетке, а значит, и заряды их ядер, влияющие на эти расстояния.
Определение периода и группы в Периодической системе
Зарядовое число элемента напрямую связано с его положением в Периодической системе. Элементы в одной группе имеют одинаковое зарядовое число, а в одном периоде - возрастающее от 1 до 7 (для f-элементов до 12).
Таким образом, зная точное место элемента в таблице Менделеева, можно определить и его зарядовое число.
Химические реакции элемента
Химические свойства любого вещества также зависят от зарядового числа его атомов. Поэтому изучая реакционную способность элемента, типы образуемых им соединений, можно косвенно оценить заряд ядра.
Например, щелочные металлы с зарядом +1 образуют оксиды состава М2О, а щелочноземельные с зарядом +2 - оксиды состава МО.
Экспериментальное определение зарядового числа
Рассмотрим, как можно в домашних условиях определить зарядовое число некоторых элементов с помощью простого эксперимента.
Для этого потребуются два металла (например, цинк и медь), растворы их солей, источник тока и вольтметр. При электролизе этих растворов выделяется водород.
Измерив объем выделившегося водорода и количество электричества, затраченное на электролиз, можно рассчитать зарядовые числа обоих металлов.
Этот простой опыт наглядно демонстрирует, что заряд цинка равен +2, а меди +1. То есть в атоме цинка на 2 электрона больше, чем в атоме меди.
Зарядовое число и свойства элементов
Итак, мы рассмотрели основные способы определения зарядового числа химических элементов - от точных физических измерений до простых химических экспериментов.
Эта фундаментальная характеристика атома во многом предопределяет свойства элемента - его положение в Периодической системе, реакционную способность, типы соединений.
Поэтому умение измерять зарядовое число позволяет глубже понять природу химических элементов и расширить наши знания о мире атомов.
Применение знаний о зарядовом числе
Понимание того, что называется зарядовым числом атомного ядра, важно не только для фундаментальной науки. Эти знания активно применяются на практике.
В частности, данные о зарядовых числах элементов используются в масс-спектрометрии для идентификации веществ, в рентгеноспектральном анализе состава материалов, в ядерной физике и энергетике.
Понимание зависимости свойств элементов от зарядового числа позволяет прогнозировать химическое поведение соединений, что важно для химической промышленности и материаловедения.
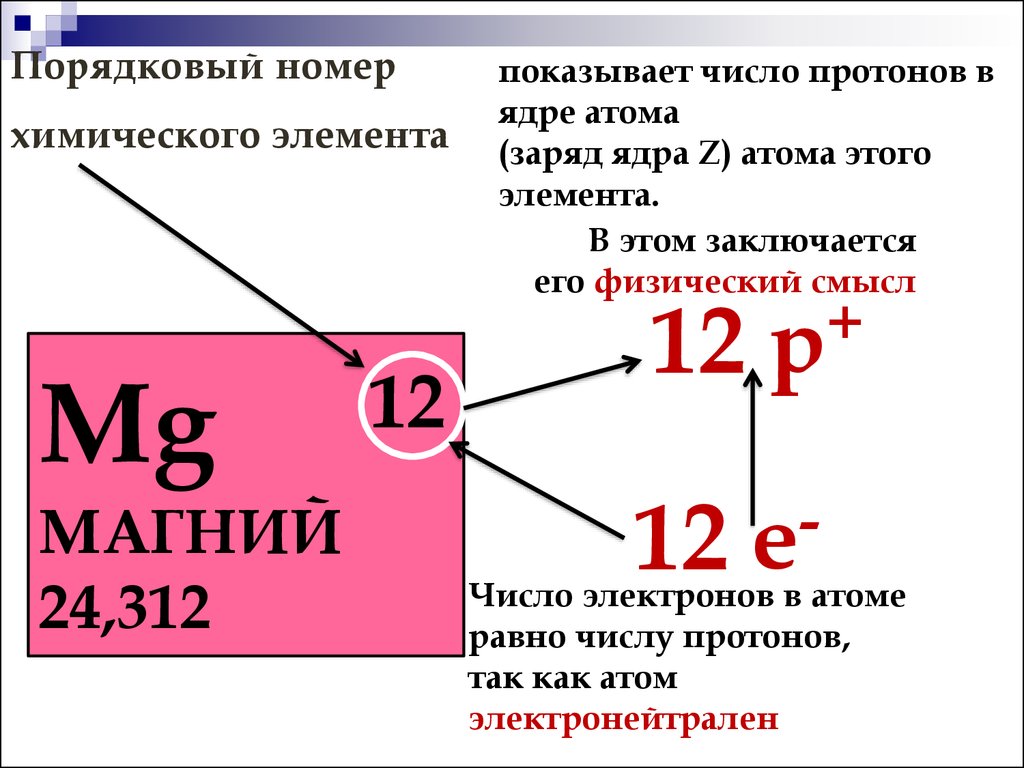
Зарядовое число и строение атома
Зарядовое число определяет не только внешние свойства атома, но и его внутреннее строение.
От количества протонов в ядре зависит количество электронов в атоме. Это влияет на заполнение электронных оболочек и подуровней, что сказывается на размерах атома, его ионизационном потенциале.
Кроме того, зарядовое число напрямую связано с порядковым номером элемента в Периодической системе. Этот порядковый номер определяет число заполняемых электронных слоев и орбиталей.
Таким образом, заряд ядра влияет на распределение электронов по уровням и подуровням, что крайне важно для понимания природы химической связи и реакционной способности.
Изотопы и зарядовое число
Хотя зарядовое число определяет число протонов в ядре атома, общее количество нуклонов может варьироваться. Это связано с существованием изотопов - разновидностей химического элемента с одинаковым зарядовым числом, но разным количеством нейтронов.
Например, углерод-12, углерод-13 и углерод-14 - изотопы углерода с зарядовым числом 6. Различия в количестве нейтронов приводят к изменению массового числа, но не затрагивают зарядовое число и химические свойства.
Изменение зарядового числа в ядерных реакциях
Хотя в обычных условиях зарядовое число элемента не меняется, в экстремальных условиях атомного ядра возможны превращения элементов друг в друга.
Ядерные реакции, сопровождающиеся изменением числа протонов, называются трансмутацией. Пример - бета-распад, при котором протон превращается в нейтрон или наоборот.
Трансмутация элементов может происходить в звездах, при взрывах ядерного оружия, а также использоваться для получения новых элементов в лаборатории.
Таким образом, хотя в обычных условиях заряд ядра постоянен, в экстремальных условиях он может изменяться согласно законам ядерной физики.
























