Химические уравнения - важный инструмент для изучения и описания химических реакций. Они позволяют наглядно представить, какие вещества вступают в реакцию, какие образуются, а также количественные соотношения реагентов и продуктов.
Чтобы научиться правильно составлять и решать уравнения реакций, нужно разобраться в основных понятиях и правилах. В этой статье мы рассмотрим классификацию реакций, этапы составления уравнений, расстановку коэффициентов, а также 5 универсальных методов, которые помогут решить любое уравнение.
Типы химических реакций и их классификация
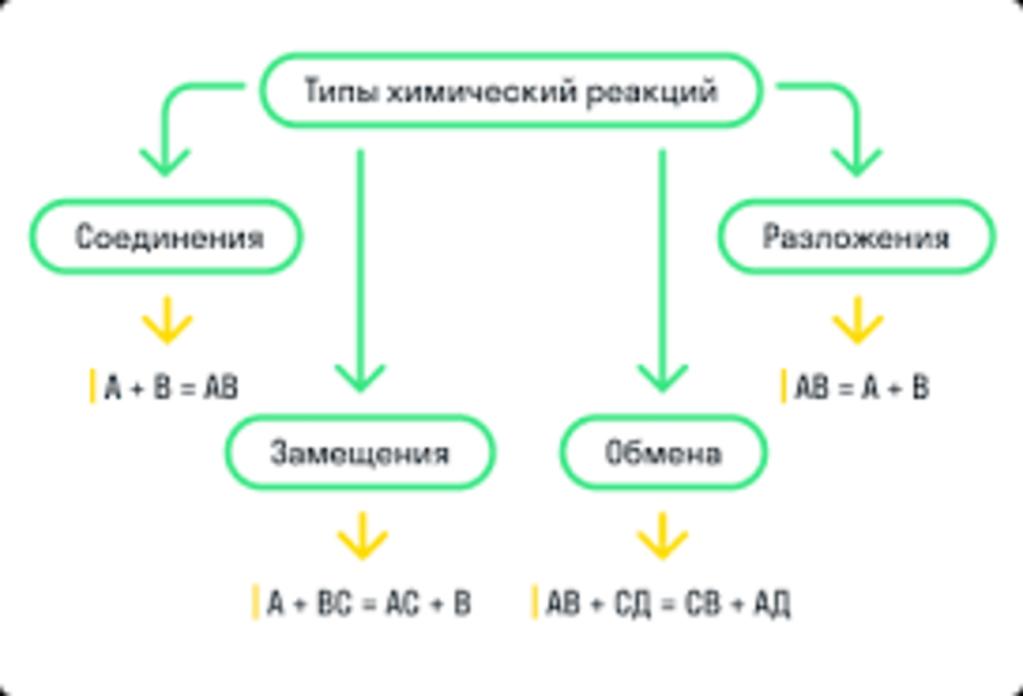
Химические реакции классифицируют по различным признакам. Одна из основных классификаций - по числу и составу исходных веществ и продуктов реакции. По этому признаку выделяют 4 типа реакций: как решать уравнения химических реакций, реакции соединения, реакции разложения, реакции замещения и реакции обмена.
- Реакции соединения - из нескольких более простых веществ образуется одно более сложное.
- Реакции разложения - из одного более сложного вещества образуется несколько более простых.
Химические уравнения как решать? Также важный признак классификации химических реакций - изменение степени окисления. По нему выделяют реакции, протекающие без изменения степени окисления, и окислительно-восстановительные реакции.
| Тип реакции | Пример |
| Соединения | Zn + S → ZnS |
| Разложения | 2H2O → 2H2 + O2 |
Помимо классификации по этим двум признакам, химические реакции также делят по другим параметрам: тепловому эффекту, агрегатному состоянию, наличию катализатора и обратимости.
Правила составления химических уравнений
Химические уравнения отображают химические реакции с помощью символов и формул. Для правильного составления уравнений реакций нужно придерживаться определенных правил. Рассмотрим основные из них.
- Записываем химические формулы исходных веществ (реагентов) в левой части уравнения.
- Между формулами реагентов ставим знак «плюс».
- После реагентов пишем знак равенства.
- Справа от знака равенства записываем формулу продукта реакции.
Формулы веществ в уравнениях записываются с учетом валентностей химических элементов. Например, молекулы H2, O2, N2 и галогенов двухатомных.
Важнейшее правило при составлении химических уравнений - соблюдение закона сохранения массы веществ. Он заключается в том, что количество каждого элемента до и после реакции должно быть одинаковым.
Для выполнения закона сохранения массы, при необходимости, перед формулами ставят коэффициенты. Они показывают число молекул или атомов вещества, участвующих в реакции.
Расстановка коэффициентов в уравнениях
Одним из важнейших этапов при составлении химических уравнений является правильная расстановка коэффициентов. Это необходимо для соблюдения закона сохранения массы веществ и указания стехиометрических соотношений реагентов.
Рассмотрим подробно процесс расстановки коэффициентов:
- Сначала записываем уравнение реакции без коэффициентов.
- Подсчитываем количество атомов каждого элемента в исходных веществах и продуктах реакции.
- Если где-то количество атомов элемента не совпадает, находим наименьшее общее кратное (НОК).
- Делим НОК на количество атомов с каждой стороны от знака равенства. Полученные числа записываем в виде коэффициентов.
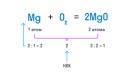
Рассмотрим пример расстановки коэффициентов в уравнении реакции между магнием и кислородом:
Mg + O2 = MgO
У магния в левой и правой частях по 1 атому. У кислорода слева 2 атома, а справа 1. НОК равно 2. Делим его на количество атомов O с каждой стороны и получаем коэффициенты:
2Mg + O2 = 2MgO
Теперь проверяем количество атомов магния. Слева - 2 атома, справа тоже 2. Закон сохранения массы выполняется.
При расстановке коэффициентов нужно действовать последовательно - сначала для одного элемента, затем для другого. И так далее, пока количество всех атомов не сравняется.

5 универсальных методов решения химических уравнений
Решение химических уравнений - важный этап работы с реакциями. Предлагаем «химические уравнения как решать» ознакомиться с 5 универсальными методами, позволяющими научиться решать уравнения разных типов.
- Метод электронного баланса. Эффективен для решения окислительно-восстановительных реакций. Заключается в подборе коэффициентов путем уравнивания количества отданных и принятых электронов.
- Метод полуреакций. Также используется для ОВР. Состоит в записи уравнений окисления и восстановления отдельно друг от друга с последующим их суммированием.
- Метод электронного баланса. Применяют для реакций ионного обмена в растворах электролитов. Необходимо уравнять суммы положительных и отрицательных зарядов ионов.
- Молекулярный метод. Подходит для уравнений реакций, протекающих без изменения степеней окисления. Основан на законе сохранения массы веществ и расстановке коэффициентов.
- Метод перебора вариантов. Используют, когда нет возможности применить предыдущие методы. Заключается в переборе различных соотношений реагентов.
Выбор метода зависит от конкретного типа химической реакции. Лучше всего их комбинировать в зависимости от ситуации.
Методы решения уравнений реакций соединения
Рассмотрим методы, с помощью которых можно решать уравнения реакций соединения. К ним относятся взаимодействия нескольких более простых веществ с образованием одного сложного продукта.
Для таких реакций чаще всего подходят два метода:
- Молекулярный метод. Основан на законе сохранения массы веществ. Необходима правильная расстановка коэффициентов для уравнивания числа атомов каждого элемента в исходных веществах и продуктах.
- Метод перебора вариантов. Применяют, если предыдущий метод не позволил сбалансировать уравнение. Путем перебора подбирают такие соотношения реагентов, чтобы выполнялся закон сохранения массы.
Рассмотрим пример:
Дано: Al + Fe2O3 → Fe + Al2O3
Сначала пробуем молекулярный метод. У алюминия слева и справа по 1 атому. У железа тоже количество совпадает. А вот кислорода слева 7 атомов, а справа 6.
Применяем метод перебора, подбирая коэффициенты. При соотношении 2:3 выполняется закон сохранения массы:
2Al + 3Fe2O3 → 3Fe + Al2O3
Таким образом, для решения уравнений реакций соединения чаще всего используют молекулярный и метод перебора вариантов, комбинируя их в зависимости от конкретной ситуации.
Методы решения уравнений реакций разложения
Рассмотрим подходы к решению уравнений реакций разложения. К ним относят распад одного сложного вещества на несколько более простых.
Для таких реакций также чаще всего используют 2 метода:
- Молекулярный метод. Как и для реакций соединения, он основан на законе сохранения массы веществ. Путем подбора коэффициентов добиваются равенства числа атомов каждого элемента слева и справа.
- Метод перебора вариантов. Позволяет решить уравнение разложения в тех случаях, когда предыдущий метод оказался безрезультатным. Решение находят перебором соотношений.
Рассмотрим пример числового решения:
Дано: CaCO3 → CaO + CO2
Пробуем сразу молекулярный метод. У кальция и углерода количество атомов слева и справа совпадает. А вот кислорода слева - 3 атома, а справа 2.
Используем метод перебора. При соотношении 1:1:1 выполняется закон сохранения массы:
CaCO3 → CaO + CO2
Методы решения уравнений реакций замещения
Реакции замещения - это реакции, в которых атомы одного элемента замещают атомы другого элемента в молекуле сложного вещества. Как решать уравнения химических реакций замещения, основано на понимании сути этих реакций.
Чтобы решить уравнение реакции замещения, нужно:
- Как решать уравнения химических реакций - определить, какой элемент замещается в молекуле сложного вещества;
- Определить, каким элементом или группой происходит замещение;
- Составить схему реакции с участием конкретных веществ.
Например, при взаимодействии цинка с соляной кислотой атомы водорода замещаются атомами цинка с образованием хлорида цинка:
| Zn + 2HCl → ZnCl2 + H2↑ | В данной реакции атомы H замещаются на атомы Zn |
То есть, как решать уравнения химических реакций замещения - определить, какой элемент выступает в роли заместителя, а какой элемент или функциональная группа замещается. После этого составить молекулярное уравнение реакции с конкретными веществами.
Методы решения уравнений реакций обмена
Реакции обмена - это реакции, в которых вещества обмениваются составными частями. Химические уравнения как решать для таких реакций:
- Определить тип реакции - реакция обмена между двумя электролитами (солями, кислотами, основаниями).
- Записать уравнение реакции между двумя электролитами с обменом ионов.
- Проверить электронейтральность левой и правой частей уравнения.
Например, при взаимодействии хлорида натрия и нитрата серебра происходит обмен ионами натрия и серебра с образованием хлорида серебра и нитрата натрия:
| NaCl + AgNO3 → NaNO3 + AgCl↓ | Происходит обмен ионами Na+ на Ag+ |
Для решения такого типа уравнений реакций обмена важно рассматривать электролиты как совокупность катионов и анионов и прослеживать их движение при обмене.
Решение задач по химическим уравнениям
Решение задач по химическим уравнениям - важный этап в изучении химии. От того, насколько хорошо вы понимаете принципы составления уравнений и умеете применять их при решении задач, зависит успешное овладение предметом.
- Внимательно изучите условие задачи, выделите данные и искомые величины
- Определите тип химической реакции, которая описана в задаче
- Составьте уравнение реакции, расставив коэффициенты
- Если в уравнении есть вещества в разных агрегатных состояниях, укажите их
- Решите уравнение относительно искомой величины
При решении задач важно правильно определить тип реакции - это ключевой момент. Обычно в условии прямо указано, что происходит: взаимодействие, разложение, замещение. Если нет, определите тип реакции по признакам:
- Реакции соединения - образуется одно сложное вещество из простых или более простых соединений
- Реакции разложения - одно сложное вещество распадается на более простые соединения или элементы
- Реакции замещения - в сложном веществе одни атомы или группы замещаются другими атомами или группами
- Реакции обмена - обмен атомами или группами между веществами
После составления уравнения внимательно проверьте соответствие закону сохранения массы, при необходимости переставьте коэффициенты. И только после этого переходите к решению задачи и нахождению искомой величины.