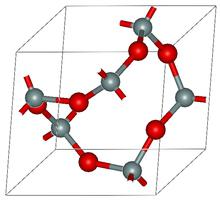
Каждый элемент способен образовывать простое вещество, находясь в свободном состоянии. В таком состоянии движение атомов происходит одинаково, они симметричны. В сложных веществах дело обстоит намного сложнее. Химические связи в таком случае асимметричны, в молекулах сложных веществ образуются сложные ковалентные связи.
Что подразумевается под окислением
Существуют такие соединения, в которых электроны распределяются максимально неравномерно, т.е. при образовании сложных веществ валентные электроны переходят от атома к атому.
Именно такая неравномерность распределения в сложных веществах называется окисленностью или окислением. Образуемый при этом заряд атома в молекуле называется степенью окисленности элементов. В зависимости от природы перехода электронов от атома к атому различают отрицательную либо положительную степень. В случае отдачи либо принятия атомом элемента нескольких электронов образуется соответственно положительная и отрицательная степени окисления химических элементов (Э+ или Э
-). Например, запись К
+1 означает, что атом калия отдал один электрон. В любом
органическом соединении центральное место занимают атомы углерода. Валентность данного элемента соответствует 4-м в любом соединении, однако в разных соединениях степень окисления углерода будет разной, она будет равна –2, +2, ±4. Такая природа разного значения валентности и степени окисления наблюдается практически в любом соединении.
Определение степени окисления
Чтобы правильно определить степень окисления, необходимо знать основополагающие постулаты.
Металлы не способны иметь минусовую степень, однако существуют редкие исключения, когда металл образует соединения с металлом. В периодической системе номер группы атома соответствует максимально возможной степени окисления: углерода, кислорода, водорода и любого другого элемента. Электроотрицательный атом при смещении в сторону другого атома одного электрона получает заряд -1, двух электронов -2 и т.д. Это правило не действует для одних и тех же атомов. Например, у связи Н-Н она будет равна 0. Связь С-Н=-1. Степень окисления углерода в связи С-О=+2. Одно и то же значение степени имеют металлы первой и второй группы системы Менделеева и фтор (-1). У водорода данная степень практически во всех соединениях равна +1, за исключением гидридов, в которых она составляет -1. Для элементов, имеющих непостоянную степень, ее можно посчитать, зная формулу соединения. Основное правило, которое гласит, что сумма степеней в любой молекуле равна 0.
Пример расчета степени окисления
Рассмотрим расчет степени окисления на примере углерода в соединении CH3CL. Возьмём исходные данные: степень у водорода равна +1, у хлора -1. Для удобства в расчете х будем считать степень окисления углерода. Тогда, для CH3CL будет иметь место уравнение х+3*(+1)+(-1)=0. Произведя несложные арифметические действия, можно определить, что степень окисления углерода будет равняться +2. Таким способом можно произвести расчеты для любого элемента в сложном соединении.