Окислительно-восстановительный потенциал (ОВП) измеряется в вольтах (V) или милливольтах (мВ). Чем более положительный потенциал, тем большую тенденцию к сокращению и восстановлению имеет вещество. ОВП является общим показателем качества воды и часто используется при анализе состояния питьевых вод, последствий кислотных дождей, токсичных выбросов в атмосферу и т.д.
Общее описание
В водных растворах окислительно-восстановительный потенциал является мерилом тенденции решения либо получить, либо потерять электроны, когда он подвергается изменению путем введения нового вещества. Решение с более высоким (более положительным) потенциалом восстановления, чем новый вид вещества, будет иметь тенденцию получать электроны от новых видов (т.е. восстанавливаться путем их окисления), а раствор с более низким (более отрицательным) потенциалом восстановления будет иметь тенденцию к потере электронов для новых видов (т.е. окисляться путем их уменьшения). Поскольку абсолютные потенциалы трудно точно измерить, редукционные потенциалы определяются относительно эталонного электрода. Редокс-потенциалы водных растворов определяются путем измерения разности ОВП между инертным чувствительным электродом в контакте с раствором и стабильным эталонным электродом, соединенным с раствором солевым мостиком.

Самые благоприятные металлы
Чувствительный электрод действует как платформа для переноса электрона в опорную половину ячейки или из нее. Это, как правило, платина, хотя золото и графит также могут использоваться. Эталонная полуячейка состоит из стандартного ОВП. Стандартный водородный электрод является эталоном, из которого определяются все стандартные окислительно-восстановительные потенциалы, и ему был задан произвольный потенциал полуэлемента 0,0 мВ. Однако он является хрупким и непрактичным для обычного лабораторного использования. Поэтому другие более стабильные эталонные электроды такие, как хлорид серебра и насыщенный каломель (SCE), обычно используются из-за их более надежной работы.
Дополнительные факторы
Хотя измерение потенциала восстановления в водных растворах является относительно простым, многие факторы ограничивают его интерпретацию, например, влияние температуры раствора и рН, необратимые реакции, медленная кинетика электродов, неравновесность, наличие множественных окислительно-восстановительных пар, отравление электродами, небольшой обмен токов и инертных редокс-пар. Следовательно, практические измерения редко коррелируют с вычисленными значениями. Тем не менее, измерение редокс-потенциала оказалось полезным в качестве аналитического инструмента для мониторинга изменений в системе, а не для определения их абсолютной величины.
Подобно тому, как перенос ионов водорода между химическими видами определяет рН водного раствора, перенос электронов между химическими видами определяет потенциал его восстановления. Как и рН, окислительно-восстановительный потенциал представляет собой то, как сильно электроны переносятся внутрь или вовне раствора. Он не характеризует количество электронов, доступных для окисления или восстановления, во многом таким же образом, как рН не характеризует буферную способность вещества.

Стандарты
Фактически в решении можно определить pE, отрицательный логарифм концентрации электронов (-log), который будет прямо пропорционален стандартному окислительно-восстановительному потенциалу. Иногда pE используется как единица потенциала восстановления вместо Eh, например, в области химии окружающей среды. Если мы нормируем pE водорода как ноль, мы будем иметь отношение pE = 16,9 Eh при комнатной температуре. Эта точка зрения полезна для понимания значения окислительно-восстановительного потенциала, хотя перенос электронов, а не абсолютная концентрация свободных электронов в тепловом равновесии, заключается в том, как обычно думают об ОВП. Теоретически однако оба подхода эквивалентны друг к другу.
И наоборот, можно определить потенциал, соответствующий рН, в качестве разности потенциалов между растворенной и нейтральной по рН водой, разделенной пористой мембраной (проницаемой для ионов водорода). Такие разности потенциалов действительно происходят из-за различий в кислотности на биологических мембранах. Этот потенциал (где рН равен 0 В) аналогичен окислительно-восстановительному потенциалу (где стандартизованный раствор водорода задан равным 0 В), но вместо ионов водорода электроны переносятся в окислительно-восстановительном ядре. Как pH, так и ОВП являются свойствами растворов, а не элементов или химических соединений как таковых, и зависят от концентраций, температуры и прочих сторонних факторов.
Таблица окислительно-восстановительных потенциалов
Относительную реактивность различных растворов можно сравнить с предсказанием направления потока электронов. Более высокое значение ОВП означает, что существует большая тенденция к восстановлению, а более низкое – что существует большая тенденция к окислению. Человек, знакомый с химией, поймет это по таблицам окислительно-восстановительных потенциалов, представленным ниже.
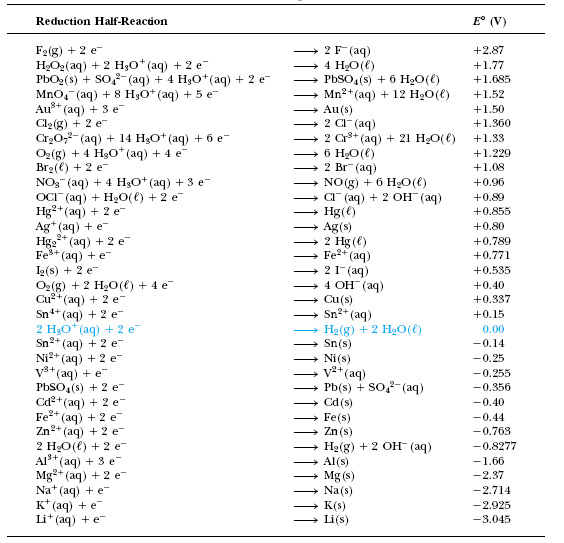
Любая система или окружающая среда, которая принимает электроны от нормального водородного электрода, представляет собой полуэлемент, который определяется как имеющий положительный ОВП. Любая система, передающая электроны на водородный электрод, определяется как имеющая отрицательный окислительно-восстановительный потенциал. ОВП часто измеряется в милливольтах (мВ). Высокий положительный ОВП обозначает среду, которая благоприятствует реакции окисления (такую, как свободный кислород). Низкий отрицательный окислительно-восстановительный потенциал (воды) указывает на сильную восстанавливающую среду (такую, как свободные металлы).
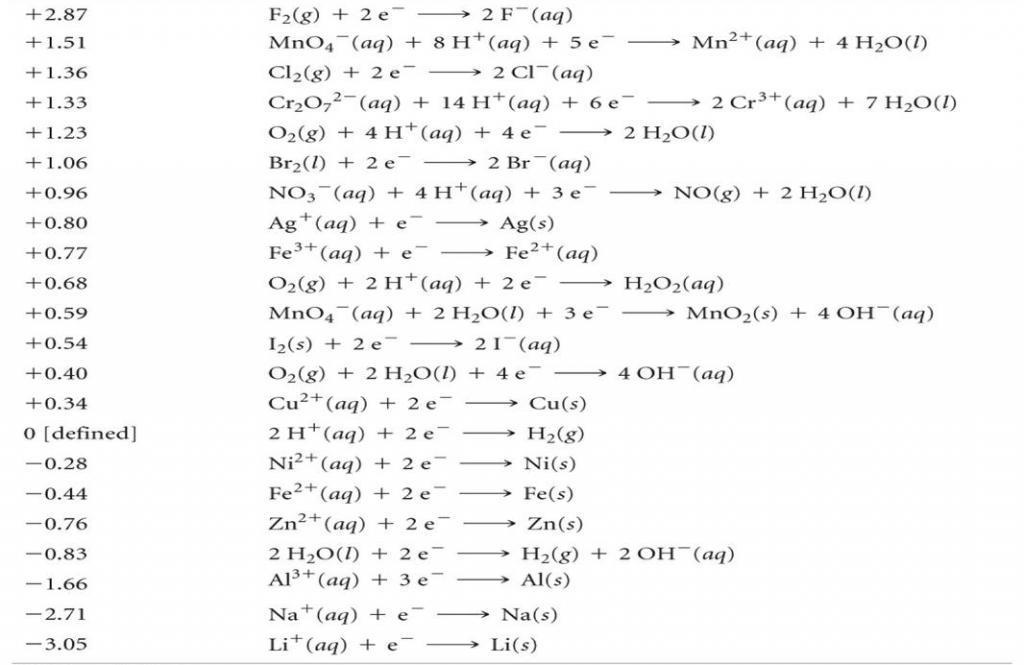
Особенность воды
Иногда, когда электролиз проводят в водном растворе, вода, не будучи смешанной с другим веществом, окисляется или восстанавливается. Например, если водный раствор NaCl электролизуется, вода может быть уменьшена на катоде с образованием ионов H2 (g) и OH-, а Na + восстанавливается до Na (s), как это происходит в отсутствие воды. Это потенциал каждого присутствующего вида, который определит, какие виды будут окислены или восстановлены.
Абсолютные потенциалы
Абсолютные потенциалы восстановления могут быть определены, если мы найдем фактический потенциал между электродом и электролитом для любой реакции. Поверхностная поляризация мешает измерениям, но различные источники дают предполагаемый потенциал для стандартного водородного электрода от 4,4 до 4,6 В (электролит положительный). Так и измеряют потенциал окислителя/восстановителя.
Уравнения с полуэлементами можно объединить, если обратить их на окисление таким образом, чтобы нейтрализовать электроны, дабы получить уравнение без электронов в нем.
Но на этом еще не все. Многие ферментативные реакции представляют собой реакции окислителя-восстановителя, в которых одно соединение окисляется, а другое – восстанавливается. Способность организма проводить подобные реакции зависит от состояния окружающей среды с точки зрения ОВП.
Аэробы и анаэробы
Строго аэробные микроорганизмы обычно активны при положительных значениях окислительно-восстановительного (ОВП), тогда как строгие анаэробы обычно активны при отрицательных значениях. Редокс влияет на растворимость питательных веществ, особенно ионов металлов.
Есть организмы, которые могут регулировать метаболизм в своей среде, например, факультативные анаэробы. Они могут быть активны при положительных значениях Eh и при отрицательных значениях Eh в присутствии кислородсодержащих неорганических соединений, таких как нитраты и сульфаты.
Практическое применение
В области химии окружающей среды потенциал восстановления используется для определения того, преобладают ли окислительные или восстановительные условия в воде или почве, а также для прогнозирования состояний различных химических веществ в воде (таких, как растворенные металлы).
pE в диапазоне от -12 до 25 – это уровни, в которых сама вода восстанавливается или окисляется, соответственно.
В природе
Редукционные потенциалы в естественных системах часто связаны с естественной устойчивостью воды. Аэрированные поверхностные воды, реки, озера, океаны, дождевая вода и кислотные шахтные воды обычно имеют окислительные условия (положительные потенциалы). В местах с ограничениями в подаче воздуха, таких как подземные каналы естественного происхождения, болота и морские осадки, нормой являются восстановительные условия (отрицательные потенциалы). Промежуточные значения являются редкими и обычно бывают временным условием, которое обнаруживается в системах, движущихся к более высоким или меньшим значениям pE.

В экологических ситуациях принято иметь сложные неравновесные условия между большим количеством видов веществ, что означает, что часто невозможно сделать точные и однозначные измерения потенциала восстановления. Однако обычно можно получить приблизительное значение и определить условия, как находящиеся в окислительном или восстановительном режиме.
В почве присутствуют такие основные окислительно-восстановительные компоненты:
- Неорганические окислительно-восстановительные системы (главным образом окси / красные соединения Fe и Mn) и измерение в водных экстрактах.
- Образцы естественных почв со всеми микробными и корневыми компонентами и измерения прямым методом.
Современные исследования
Потенциал окислительного восстановления (ОВП) может использоваться для мониторинга системы водоснабжения с использованием одноценной меры дезинфекционного потенциала, показывающей активность дезинфицирующего средства, а не применяемой дозы. Например, E. coli, Salmonella, Listeria и другие патогены имеют время выживания менее 30 с, когда ОВП выше 665 мВ, по сравнению с> 300 с, когда он ниже 485 мВ.

Схемы Eh-pH (Pourbaix) обычно используются в горнодобывающей промышленности и геологии для оценки полей устойчивости минералов и растворенных видов соединений. В условиях, когда минеральная (твердая) фаза является наиболее устойчивой формой элемента, эти диаграммы показывают, что собой представляет минерал с химической точки зрения. Как и результаты всех термодинамических (равновесных) оценок, эти диаграммы следует использовать с осторожностью. Хотя образование минерала или его растворение может быть предсказано в рамках ряда условий, процесс может быть незначительным, поскольку его скорость довольно медленная. В этих условиях необходимы кинетические оценки. Однако условия равновесия можно использовать для оценки направления спонтанных изменений и величины движущей силы позади них. Определение окислительно-восстановительного потенциала в горнодобывающей промышленности имеют очень большую перспективу в наше время. В других целях эта процедура не так полезна, но все же очень важна, поскольку помогает определить многие химические характеристики какого-либо сложного соединения.



























