Многие процессы, без которых невозможно представить нашу жизнь (такие как дыхание, пищеварение, фотосинтез и подобные им), связаны с различными химическими реакциями органических соединений (и неорганических). Давайте рассмотрим основные их виды и более детально остановимся на процессе под названием соединение (присоединение).
Что называется химической реакцией
Прежде всего стоит дать общее определение этому явлению. Под рассматриваемым словосочетанием подразумеваются различные реакции веществ разной сложности, в результате которых образуются отличные от исходных продукты. Участвующие в этом процессе вещества именуются "реагенты".
На письме химическая реакция органических соединений (и неорганических) записывается при помощи специализированных уравнений. Внешне они немного напоминают математические примеры по сложению. Однако вместо знака равно ("=") используются стрелки ("→" или "⇆"). Помимо этого в правой части уравнения иногда может быть больше веществ, нежели в левой. Все, что находится до стрелки, - это вещества до начала реакции (левая часть формулы). Все, что после нее (правая часть), - соединения, образовавшиеся в результате произошедшего химического процесса.
В качестве примера химического уравнения можно рассмотреть реакцию разложения воды на водород и кислород под действием электрического тока: 2Н2О → 2Н2↑ + О2↑. Вода - это исходный реагент, а кислород с водородом - продукты.
В качестве еще одного, но уже более сложного примера химической реакции соединений можно рассмотреть явление, знакомое каждой хозяйке, хоть раз выпекавшей сладости. Речь идет о гашении пищевой соды с помощью столового уксуса. Происходящее действие иллюстрируется при помощи такого уравнения: NaHCO3 +2 СН3СООН → 2CH3COONa + СО2↑ + Н2О. Из него ясно, что в процессе взаимодействия гидрокарбоната натрия и уксуса образуется натриевая соль уксусной кислоты, вода и углекислый газ.
По свой природе химические процессы занимает промежуточное место между физическими и ядерными.
В отличие от первых, участвующие в химических реакциях соединения способны менять свой состав. То есть из атомов одного вещества можно образовать несколько других, как в вышеупомянутом уравнении разложения воды.
В отличие от ядерных реакций химические не затрагивает ядра атомов взаимодействующих веществ.
Какие бывают виды химических процессов
Распределение реакций соединений по видам происходит по разным критериям:

- Обратимость/необратимость.
- Наличие/отсутствие катализирующих веществ и процессов.
- По поглощению/выделению тепла (эндотермическая/экзотермическая реакции).
- По количеству фаз: гомогенные/гетерогенные и две гибридные их разновидности.
- По изменению степеней окисления взаимодействующих веществ.
Виды химических процессов в неорганической химии по способу взаимодействия
Этот критерий является особым. С его помощью выделяют четыре разновидности реакций: соединение, замещение, разложение (расщепление) и обмен.
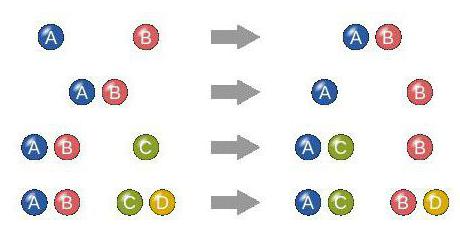
Название каждой из них соответствует процессу, который она описывает. То есть в соединении вещества объединяются, в замещении - меняются на другие группы, в разложении из одного реагента образуется несколько, а в обмене участники реакции меняются между собой атомами.
Виды процессов по способу взаимодействия в органической химии
Несмотря на большую сложность, реакции органических соединений происходят по тому же принципу, что и неорганические. Однако они имеют несколько отличные названия.
Так, реакции соединения и разложения именуются «присоединение», а также «отщепление» (элимирование) и непосредственно органическое разложение (в этом разделе химии присутствуют два типа процессов расщепления).
Другие реакции органических соединений - это замещение (название не меняется), перегруппировка (обмен) и окислительно-восстановительные процессы. Несмотря на схожесть механизмов их протекания, в органике они более многогранны.
Химическая реакция соединения
Рассмотрев различные виды процессов, в которые вступают вещества в органической и неорганической химии, стоит остановиться более подробно именно на соединении.
Данная реакция отличается от всех остальных тем, что, независимо от количества реагентов в ее начале, в финале они все соединяются в одно.
В качестве примера можно вспомнить процесс гашения извести: СаО + Н2О → Са(ОН)2. В данном случае происходит реакция соединения оксида кальция (негашеной извести) с оксидом гидрогена (водой). В результате образуется гидроксид кальция (гашеная известь) и выделяется теплый пар. Кстати, это означает, что данный процесс действительно экзотермический.
Уравнение реакции соединения
Схематически рассматриваемый процесс можно изобразить следующим образом: А+БВ → АБВ. В данной формуле АБВ – это новообразованное сложное вещество, А – простой реагент, а БВ – вариант сложного соединения.
Стоит отметить, что эта формула характерна и для процесса присоединения и соединения.
Примеры реакции рассматриваемой - это взаимодействие оксида натрия и углекислого газа (NaO2 + СО2↑ (t 450-550 °С) → Na2CO3), а также оксида серы с кислородом (2SO2 + O2↑ → 2SO3).
Также между собой способны реагировать несколько сложных соединений: АБ + ВГ → АБВГ. Например, все тот же оксид натрия и оксид гидрогена: NaO2 +Н2О → 2NaOH.
Условия протекания реакции в неорганических соединениях
Как было показано в предыдущем уравнении, в рассматриваемое взаимодействие способны вступать вещества разной степени сложности.
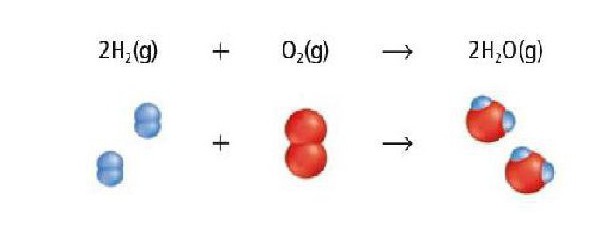
При этом для простых реагентов неорганического происхождения возможны окислительно-восстановительные реакции соединения (А + В → АБ).
В качестве примера можно рассмотреть процесс получения трехвалентного хлорида железа. Для этого проводится реакция соединения между хлором и ферумом (железом): 3Cl2↑ + 2Fe → 2FeCl3.
В случае если речь идет о взаимодействии сложных неорганических веществ (АБ + ВГ → АБВГ), процессы в них способны происходить, как влияя, так и не влияя на их валентность.
Как иллюстрацию к этому стоит рассмотреть пример образования гидрокарбоната кальция из углекислого газа, оксида гидрогена (воды) и белого пищевого красителя Е170 (карбоната кальция): СО2↑ + Н2О +СаСО3 → Са(СО3)2. В данном случае имеет место классическая реакция соединения. При ее осуществлении валентность реагентов не меняется.
Чуть более совершенное (нежели первое) химическое уравнение 2FeCl2 + Cl2↑ → 2FeCl3 является примером окислительно-восстановительного процесса при взаимодействии простого и сложного неорганических реагентов: газа (хлора) и соли (хлорида железа).
Виды реакций присоединения в органической химии
Как уже было указано в четвертом пункте, в веществах органического происхождения рассматриваемая реакция именуется «присоединением». Как правило, в ней принимают участие сложные вещества с двойной (или тройной) связью.
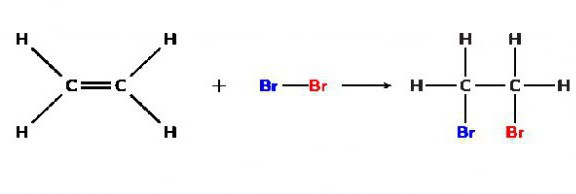
Например, реакция между дибромом и этиленом, ведущая к образованию 1,2-дибромэтана: (С2Н4) СН2= СН2 + Br2 → (C₂H₄Br₂) BrCH2 - CH2Br. Кстати, знаки похожие на равно и минус ("=" и "-"), в данном уравнении показывают связи между атомами сложного вещества. Это особенность записи формул органических веществ.
В зависимости от того, какие из соединений выступают в роли реагентов, выделяются несколько разновидностей рассматриваемого процесса присоединения:
- Гидрирование (добавляются молекулы гидрогена Н по кратной связи).
- Гидрогалогенирование (присоединяется галогеноводород).
- Галогенирование (добавление галогенов Br2, Cl2↑ и подобных).
- Полимеризация (образование из нескольких низкомолекулярных соединений веществ с высокой молекулярной массой).
Примеры реакции присоединения (соединения)
После перечисления разновидностей рассматриваемого процесса стоит узнать на практике некоторые примеры реакции соединения.
В качестве иллюстрации гидрирования можно обратить внимание на уравнение взаимодействия пропена с водородом, в результате которого возникнет пропан: (С3Н6↑) СН3—СН=СН2↑ + Н2↑ → (С3Н8↑) СН3—СН2—СН3↑.
В органической химии реакция соединения (присоединения) может происходить между соляной кислотой (неорганическое вещество) и этиленом с формированием хлорэтана: (С2Н4↑) СН2= СН2↑ + HCl → CH3— CH2—Cl (C2H5Cl). Представленное уравнение является примером гидрогалогенирования.
Что касается галогенирования, то его можно иллюстрировать реакцией между дихлором и этиленом, ведущей к образованию 1,2-дихлорэтана: (С2Н4↑) СН2= СН2 + Cl2↑ → (C₂H₄Cl₂) ClCH2-CH2Cl.
Множество полезных веществ образовывается благодаря органической химии. Реакция соединения (присоединения) молекул этилена с радикальным инициатором полимеризации под воздействием ультрафиолета – тому подтверждение: n СН2 = СН2 (R и УФ-свет) → (-СН2-СН2-)n. Образованное таким способом вещество хорошо известно каждому человеку под именем полиэтилена.

Из этого материала изготавливаются различные виды упаковок, пакеты, посуда, трубы, утепляющие вещества и многое другое. Особенностью данного вещества является и возможность его вторичной переработки. Своей популярностью полиэтилен обязан тому, что не разлагается, из-за чего экологи негативно относятся к нему. Однако в последние годы был найден способ безопасной утилизации изделий из полиэтилена. Для этого материал обрабатывается азотной кислотой (HNO3). После чего отдельные виды бактерий способны разлагать это вещество на безопасные составляющие.
Реакция соединения (присоединения) играет важную роль в природе и жизни человека. Помимо этого, она часто используется учеными в лабораториях, чтобы синтезировать новые вещества для различных важных исследований.


























