К середине XX века в химической науке появился термин – металлы стратегического значения. Под ним подразумевали группу элементов, физико-химические свойства которых позволяли их использовать в производствах военно-промышленного комплекса. Речь идет о таких металлах, как хром, тантал, ниобий, молибден и вольфрам. Ванадий, свойства которого мы рассмотрим в данной статье, также по праву занимает одно из центральных мест среди металлов, применяемых в современном машиностроении, черной металлургии, инструментальном и химическом производстве. Металл образует с кислородом четыре оксида, проявляя в них валентность, равную 2, 3, 4 и 5. Наибольший практический интерес представляет соединение с наивысшей степенью окисления металла – V2O5, которое мы изучим более подробно.

Знакомимся с ванадием
В химической науке существует давно устоявшееся правило, гласящее, что характеристику химического элемента нужно начинать с его положения в периодической системе Д.И. Менделеева. Химическая формула ванадия как простого вещества – V, порядковый номер – 23, атомная масса - 50,9414. Он располагается в четвертом периоде, пятой группе и, вместе с ниобием и танталом, является типичным представителем тугоплавких металлов. Образцы чистого вещества пластичны и имеют серебристо-серый цвет. Атом ванадия является d-элементом, имеет на последнем энергетическом уровне два s-электрона, однако валентными будут также и те отрицательные частицы, которые расположены на d-подуровне этого же четвертого уровня.
Где встречается металл и каковы его физические свойства
Сам элемент в чистом виде в природе не найти. Зато он присутствует в качестве обязательного компонента в полиметаллических и железных рудах. Ранее мы говорили о пластичности и ковкости простого вещества, теперь добавим, что важные физические свойства ванадия – это высокие температуры кипения и плавления, равные, соответственно, 3400 °С и 1920 °С. Подобно титану он резко ухудшает свои физико-химические параметры при загрязнении такими примесями, как азот, водород или кислород. В частности, снижаются его пластичность и механическая прочность, и ванадий становится хрупким.
Особенные химические свойства
Металл способен к пассивации, т.е. имеет уникальную способность противостоять действию агрессивных химических сред: растворам кислот, щелочей и солей, образуя на своей поверхности защитную пленку - оксид ванадия. Кристаллическая решетка элемента имеет кубическую структуру. Отметим также, что антикоррозионная стойкость сталей, содержащих элемент, очень высока, что позволяет использовать их в качестве несущих креплений опор мостов и морских нефтяных буровых установок. Нельзя представить без ванадийсодержащих сталей и современное инструментальное производство. Вместе с ниобием, хромом и титаном элемент применяют для легирования специальных сплавов, применяемых в ракетостроении и космической промышленности. Однако концентрированная нитратная и сульфатная кислоты, раствор фтороводорода в воде и смесь хлоридной и нитратной кислот, называемая царской водкой, легко взаимодействуют с металлом. Элемент ванадий как простое вещество может реагировать с хлором, бромом, серой, при этом образуются соответствующие соли. С кислородом дает несколько оксидов, сильно отличающихся между собой своими химическими свойствами. Рассмотрим их далее.

Основные и амфотерные оксиды
Металл образует два оксида – VO и V2O3, которые проявляют типичные основные свойства. В лаборатории монооксид добывают реакцией восстановления V2O5 мелкодисперсным порошком ванадия. Основные оксиды реагируют с растворами кислот, образуя соответствующие соли. А уже из них можно получить гидроксиды, проводя реакцию обмена со щелочами. Оксид ванадия (III) обнаруживается в качестве компонента минерала карелианита, а получают его в лабораторных условиях при нагревании V2O5 с серой, углем или водородом. Оба основных оксида имеют сильно выраженные восстановительные свойства. Оксид VO2 - это типичное амфотерное соединение, вступающее в реакцию как с кислотами, так и со щелочами. В растворе, pH которого меньше 7, обнаруживаются положительно заряженные ионы ванадила VO2+, придающие раствору светло-синий цвет, а в щелочной среде образуются соли поливанадиевой кислоты. Оксид ванадия (IV) притягивает воду, т.е. является гигроскопичным веществом, в реакциях ведет себя, как восстановитель.

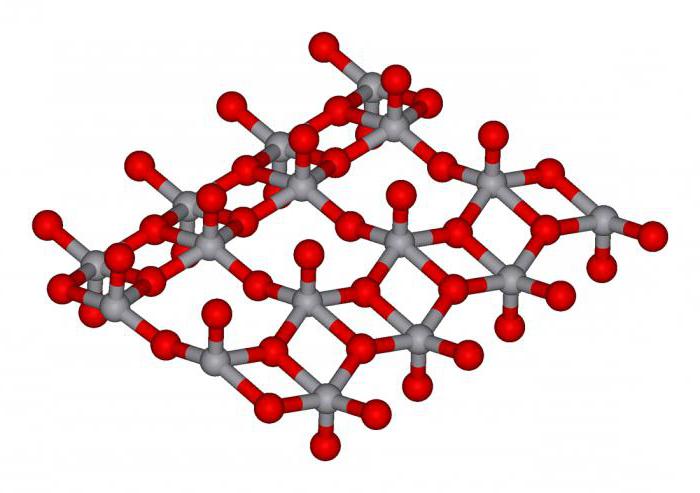
Гемипентоксид ванадия
Соединение, формула которого V2O5, - наиболее важный оксид металла. Это водоростворимое кристаллическое вещество оранжевого цвета, реагирующее со щелочами с образованием ванадатов – солей метаванадиевой кислоты HVO3. Широко применяется в качестве катализатора в реакции окисления двуокиси серы до серного ангидрида в промышленном производстве сульфатной кислоты. Пятиокись ванадия имеет ромбическую кристаллическую решетку и признаки амфотерности с преобладанием свойств кислотного оксида. В реакциях ведет себя как сильный окислитель. Соединение применяют в технологиях стекловарения, медицине и в органическом синтезе.
Способы извлечения ванадия из его соединений
Ранее мы упоминали о том, что металл является компонентом железной руды. В доменном производстве элемент вместе с примесями углерода и фосфора переходит в чугун. При выплавке стали оксид ванадия 5 осаждается в составе шлака, где его содержание может достигать 16 %. Добавляя к нему поваренную соль и проводя обжиг смеси в печах, получают продукт, который в дальнейшем растворяют в воде. Полученный водный концентрат обрабатывают сульфатной кислотой и выделяют из него V2O5. Чтобы выделить из оксида чистый ванадий, можно воспользоваться методом кальциетермии - восстановлением металлов с помощью металлического кальция. Для снижения технологических затрат в реакции с пятиокисью ванадия вместо кальция часто используют алюминий. Металл можно получить и восстановлением оксида трехвалентного ванадия углем.
Биологическая роль
Ванадий присутствует в живых организмах как микроэлемент, входящий в состав межклеточной жидкости морских иглокожих. У голотурий и морских ежей он связан с белками, которые выполняют функцию транспортировки к клеткам кислорода и удаления углекислого газа. Незначительно содержание элемента в организмах теплокровных животных и человека, где он находится в составе ферментов поджелудочной железы, в нейроглии и нефронах. В растениях микроэлемент участвует в качестве фермента темновой фазы фотосинтеза и влияет на уровень пигмента хлорофилла, находящегося в хлоропластах. Он также обнаруживается в клубеньковых бактериях, являющихся азотофиксаторами, в тканях высших грибов. В составе чернозема, наряду с соединениями бора, меди, цинка и марганца, оксид ванадия влияет на плодородие почвы.

В нашей статье мы изучили основные свойства ванадия и его оксидов, а также рассмотрели применение его соединений в промышленности.