Большая часть ферментов для осуществления каталитической активности нуждается во вспомогательных элементах — кофакторах. Эти вещества имеют небелковую природу и не всегда являются структурной частью молекулы энзима. Функциональный комплекс белка и кофактора называют холоферментом, а только белковую часть — апоферментом. Кофактор, который постоянно входит в состав фермента и соединен с ним ковалентными связями, называют простетической группой.
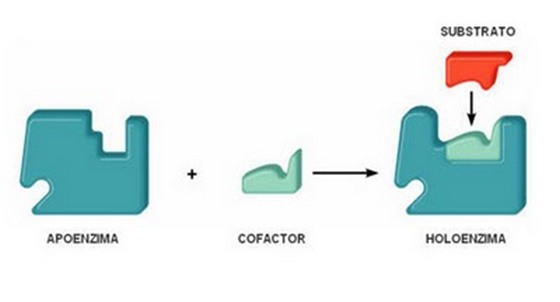
В более широком значении кофактор — это дополнительная группа в составе любого сложного белка, поддерживающая его в функциональном состоянии. У белков-энзимов кофакторы могут принимать непосредственное участие в реакции катализа.
Характеристика и виды кофакторов
Кофакторы — это низкомолекулярные вещества, которые по химической природе делятся на 2 большие группы:
- ионы двухвалентных металлов (цинк, магний, калий, медь, марганец, железо и т. д.);
- коферменты — органические небелковые соединения.
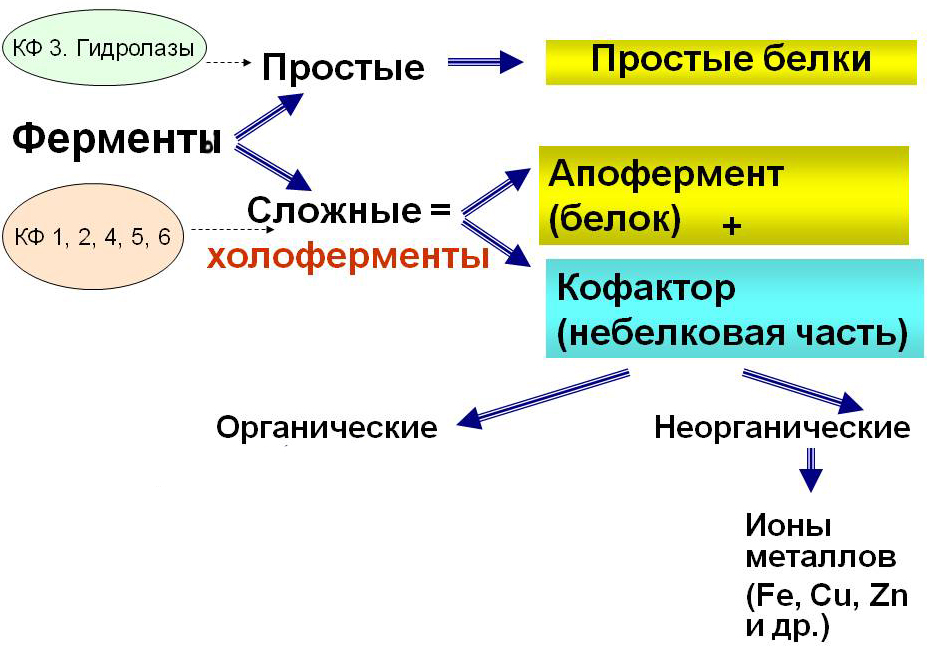
В свою очередь, коферменты подразделяют на витамины с их производными и соединения невитаминной природы. К последним относят:
- УДФ-глюкозу;
- нуклеотиды;
- металлопорфирины;
- ФАД, НАД+, НАДФ+;
- глутатион;
- убихинон;
- S-аденозилметионин.
Кофакторы могут образовывать с ферментами как сильные ковалентные, так и слабые связи. Некоторые группы взаимодействуют с полипептидной частью настолько прочно, что их трудно отделить даже химическим путем.
Сложности в определении понятий "кофактор" и "кофермент"
В узком смысле кофакторы — это ионы металлов, а коферменты — группы органической природы. Если рассматривать эти элементы с точки зрения их функционального значения, то кофактор не участвует в реакции катализа, а значит, не является коферментом. В обобщенной интерпретации кофермент представляет собой частный случай кофактора.
Такое количество трактовок связано с тем, что в современной биохимии эти термины представляют собой двусмысленные понятия, не имеющие универсального определения.
Биологическая роль кофакторов
Кофакторы ферментов могут выполнять различные функции, включая:
- участие в образовании и стабилизации третичной и четвертичной конформаций;
- стабилизация субстрата или каталитического центра, обеспечение комплементарности между ними;
- участие в катализе в качестве дополнительного субстрата;
- регуляция ферментативной активности;
- участие в реакциях окисления-восстановления.
Вне зависимости от механизма действия и химической природы кофактора, при его отсутствии энзим не может осуществлять каталитическую активность. Однако есть небольшая группа ферментов, функционирование которых с кофакторами не связано.




















