Как составляется характеристика азота по плану? 9 класс – это курс неорганической химии, в рамках которого школьники знакомятся с важнейшими элементами таблицы Д. И. Менделеева, а также со свойствами и областями применения их соединений. Существует определенный алгоритм (план), по которому происходит знакомство девятиклассников с представителем определенной группы элементов.
Последовательность действий
Что представляет собой характеристика азота? По плану (9 класс, Габриелян О. С.) сначала указывается:
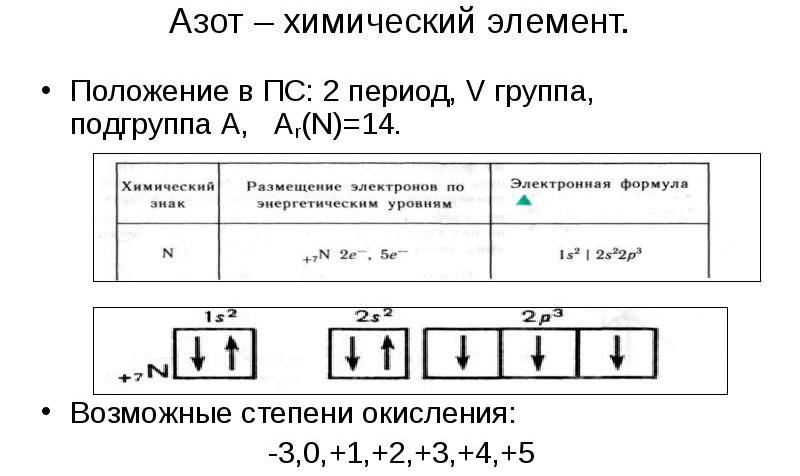
- Положение в таблице химических элементов. В данном пункте предполагается указание группы и подгруппы, периода, валентностей и степеней окисления, строение атома (число протонов, электронов, нейтронов), электронная конфигурация.
- Следующим пунктом является сравнение его химических свойств (способности принимать и отдавать электроны) с соседними по группе, периоду элементами. Для этого составляют электронные конфигурации атомов, учитывается радиус каждого, количество электронов на внешнем энергетическом уровне.
- Далее оценивается нахождение в природе, основные соединения.
- При описании физических свойств учитываются все модификации (при их наличии).
- При рассмотрении химических свойств характеризуемого элемента отмечают условия протекания взаимодействий.
- Важное место отводится описанию областей применения самого элемента, а также его важнейших соединений.
Краткая информация
Общая характеристика элементов подгруппы азота поможет выявить характерные физические и химические свойства всех ее представителей. Их отличительной особенностью является наличие на внешнем энергетическом уровне пяти валентных электронов. В химических взаимодействиях представители данной группы могут проявлять окислительные свойства. Наблюдается увеличение радиуса атома от азота к висмуту, в результате чего усиливаются металлические (восстановительные) способности.
Историческая справка
Ею дополняется характеристика азота по плану. 9 класс предполагает подготовку учащихся к итоговой аттестации, в том числе и по химии. Для того чтобы осуществлялось всестороннее развитие школьников, можно включить в обзор историческую информацию.
Итак, как был открыт азот? Химия (9 класс, автор учебника – О. С. Габриелян) содержит полезные факты, касающиеся рассматриваемого вопроса. В 1772 году Резерфордом во время экспериментов в стеклянном куполе был обнаружен газ, который он назвал «удушливым воздухом» из-за неспособности поддерживать горение и дыхание.
В 1787 году А. Лавуазье было установлено, что азот является составной частью воздуха. К началу девятнадцатого века была определена его химическая инертность.
Положение в периодической системе
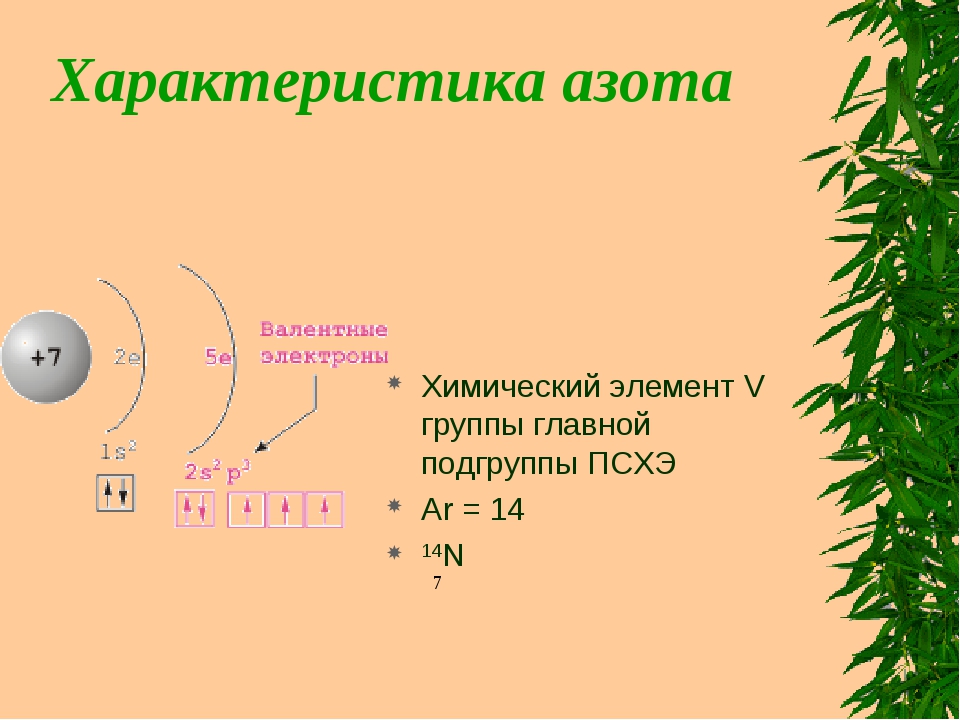
Азот – элемент пятой группы (главной подгруппы) в таблице Д. И. Менделеева. Его относительная атомная масса – 14, порядковый номер – 7. В ядре семь положительных протонов и семь нейтронов, вокруг ядра по двум орбитам движется семь электронов. Азот проявляет следующие валентности: II, IV, V, III. Его окислительная способность выражена ярче, чем у фосфора из-за меньшего радиуса атома.
Характеристика азота по плану (9 класс) предполагает распределение электронов по энергетическим уровням: 2, 5, а также составление формулы высшего оксида – N2O5. Учитывая, что азот является химически инертным элементом, получить данное соединение достаточно сложно. Летучим водородным соединением является аммиак – NH3.

Нахождение в природе
Характеристика азота по плану (9 класс) предполагает указание основных соединений, находящихся в природе, а также распространенности азота в виде простого вещества.
Он является одним из самых распространенных на нашей планете элементов. В атмосфере 78 % азота по объему без учета примесей (оксидов и аммиака). Из природных соединений интерес представляют нитраты (селитры). На протяжении длительного времени именно они использовались для промышленного синтеза аммиака.
Азот скапливается в живых организмах (в виде белковых соединений) и в почве. Характеристика азота по плану (9 класс) предполагает описание круговорота азота в природе. В учебнике О. С. Габриеляна есть схема, по которой учащиеся могут составить химические уравнения протекающих процессов.

Свойства
Общая характеристика азота подразумевает указание его физических и химических свойств. Он легче воздуха, плохо растворяется в воде, с трудом сжижается. Азот вступает в химическое взаимодействие лишь с активными металлами: магнием, кальцием, литием при нагревании. В результате реакции образуются нитриды.
Оксиды получают при воздействии на смесь ионизирующим излучением либо при атмосферных разрядах. При высокой температуре азот образует с водородом аммиак. Среди продуктов подобной реакции могут быть следующие вещества: гидразин, октазон.

Получение и применение
В лабораторных условиях азот получают при нагревании нитрита аммония. В промышленности проводят разделение сжиженного воздуха путем перегонки. Большая часть азота применяется в промышленном синтезе аммиака, из которого затем получают удобрения, азотную кислоту, взрывчатые соединения.
Свободный азот востребован в различных отраслях современной промышленности. В качестве инертной среды он применяется в металлургических и химических производствах. Азотом заполняются ртутные термометры. В жидком виде он используется в холодильных установках.
Нитраты (соли азотной кислоты), содержащие связанный азот, используются в производстве минеральных удобрений для сельского хозяйства, а также как взрывчатые соединения.



























