В органической химии можно встретить углеводородные вещества с разным количеством углерода в цепи и C=C-связью. Они являются гомологами и называются алкенами. Из-за своего строения они химически более активны, чем алканы. Но какие именно реакции для них характерны? Рассмотрим их распространение в природе, разные способы получения и применение.
Что из себя представляют?
Алкены, которые также называются олефинами (маслянистые) получили свое название от этен-хлорида, производного первого представителя этой группы. У всех алкенов есть хотя бы одна двойная C=C-связь. CnH2n - формула всех олефинов, а название образовывается от алкана с таким же количеством углеродов в молекуле, только суффикс -ан меняется на -ен. Арабской цифрой в конце названия через дефис обозначают номер углерода, от которого начинается двойная связь. Рассмотрим основные алкены, таблица поможет вам запомнить их:
| Алкан | Название | Алкен | Название |
| C2H6 | этан | C2H4 | этен (этилен) |
| C3H8 | пропан | C3H6 | пропен (пропилен) |
| C4H10 | бутан | C4H8 | бутен-1 |
| C5H12 | пентан | C5H10 | пентен-1 (амилен) |
| C6H14 | гексан | C6H12 | гексен-1 (гексилен) |
| C7H16 | гептан | C7H14 | гептен-1 (гептилен) |
| C8H18 | октан | C8H16 | октен |
| C9H20 | нонан | C9H18 | нонен |
Если молекулы имеют простое неразветвленное строение, то добавляют суффикс -илен, это также отражено в таблице.
Где их можно встретить?
Так как реакционная способность алкенов весьма высока, их представители в природе встречаются крайне редко. Принцип жизни молекулы олефинов — "давай дружить". Нет вокруг других веществ — не беда, будем дружить между собой, образуя полимеры.
Но они есть, и небольшое количество представителей входит в состав сопутствующего нефтяного газа, а высших — в нефти, добываемой на территории Канады.
Самый первый представитель алкенов этен — это гормон, стимулирующий созревание плодов, поэтому его в небольших количествах синтезируют представители флоры. Есть алкен цис-9-трикозен, который у самок мухи домашней играет роль полового аттрактанта. Еще его называют мускалур. (Аттрактант — вещества природного или синтетического происхождения, которое вызывает влечение к источнику запаха у другого организма). С точки зрения химии, алкен этот выглядит так:
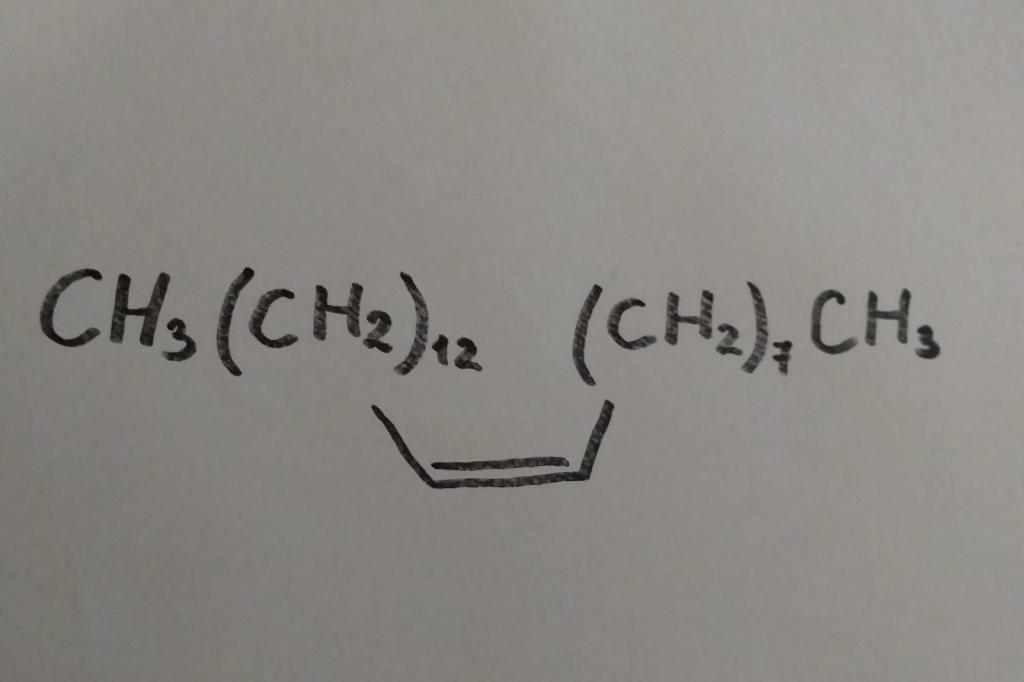
Так как весьма ценным сырьем являются все алкены, способы получения их искусственным путем весьма разнообразны. Рассмотрим наиболее распространенные.
А если нужно много?
В промышленности класс алкенов, в основном, получается при крекинге, т.е. расщеплении молекулы под воздействием высоких температур, высших алканов. Для реакции необходим нагрев в диапазоне от 400 до 700 °C. Расщепляется алкан так, как ему захочется, образуя алкены, способы получения которых мы рассматриваем, с большим количеством вариантов строения молекул:
C7H16 -> CH3-CH=CH2 + C4H10.
Еще один распространенный способ называется дегидрирование, при котором от представителя ряда алкана в присутствии катализатора отделяют молекулу водорода.
В лабораторных условиях алкены и способы получения отличаются, они основаны на реакциях элиминирования (отщепления группы атомов без их замещения). Чаще всего элиминируются атомы воды из спиртов, галогены, водород или галогенводород. Наиболее распространенный способ получения алкенов — из спиртов в присутствии кислоты, как катализатора. Возможно использование и других катализаторов
Все реакции элиминирования подчинены правилу Зайцева, гласящему:
Атом водорода отщепляется от того углерода, соседствующего с углеродом, несущим группу -OH, у которого меньше водородов.
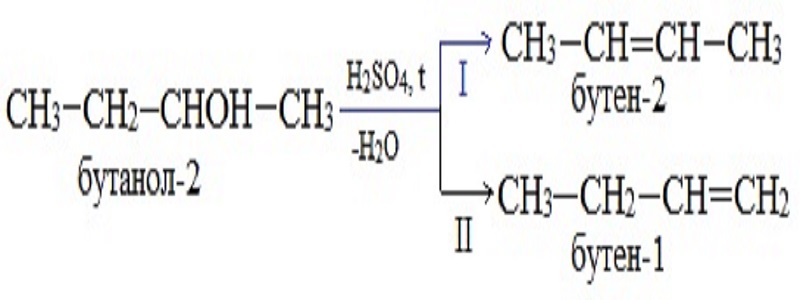
Применив правило, ответьте, какой продукт реакции будет преобладать? Позже вы узнаете, правильно ли ответили.
Химические свойства
Алкены активно реагируют с веществами, разрывая свою пи-связь (еще одно название связи C=C). Ведь она не такая прочная, как одинарная (сигма-связь). Углеводород из ненасыщенного превращается в насыщенный, не образуя других веществ после реакции (присоединение).
Далее перечислены самые распространенные реакции алкенов, которые проводятся в разных видах деятельности человека:
- присоединение водорода (гидрирование). Присутствие катализатора и нагревания нужна для ее прохождения;
- присоединение молекул галогенов (галогенирование). Является одной из качественных реакций на пи-связь. Ведь при реакции алкенов с бромной водой, она из бурой становится прозрачной;
- реакция с галогенводородами (гидрогалогенирование);
- присоединение воды (гидратация). Условиями прохождения реакции является нагревание и присутствие катализатора (кислоты);
Реакции несимметричных олефинов с галогенводородами и водой подчиняются правилу Марковникова. А значит, водород присоединится к тому углероду из двойной углерод-углеродной связи, у которого уже больше атомов водорода.
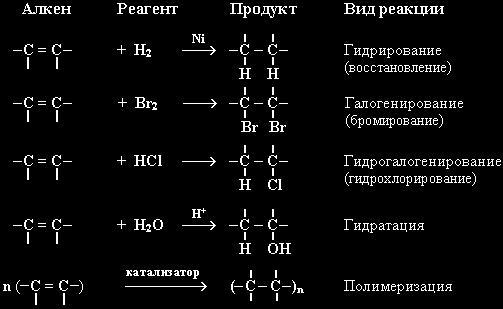
- горение;
- неполное окисление каталитическое. Продуктом являются циклические оксиды;
- реакция Вагнера (окисление перманганатом в нейтральной среде). Эта реакция алкенов — еще одна качественная C=C-связь. При протекании розовый раствор марганцовки обесцвечивается. Если ту же реакцию провести в соединенной кислой среде, продукты будут уже другими (карбоновые кислоты, кетоны, углекислый газ);
- изомеризация. Характерны все виды: цис- и транс-, перемещение двойной связи, циклизация, скелетная изомеризация;
- полимеризация — главное свойство олефинов для промышленности.
Применение в медицине
Большое практическое значение имеют продукты реакции алкенов. Многие из них используются в медицине. Из пропена получают глицерин. Этот многоатомный спирт является прекрасным растворителем, причем, если его использовать вместо воды, растворы будут более концентрированными. В медицинских целях в нем растворяют алкалоиды, тимол, йод, бром и др. Также глицерин применяют при приготовлении мазей, паст и кремов. Он предотвращает их высыхание. Сам по себе глицерин является антисептиком.
При реакции с хлороводородом получаются производные, которые применяются как местная анестезия при нанесении на кожу, а также для кратковременного наркоза при незначительных хирургических вмешательствах, при помощи ингаляций.
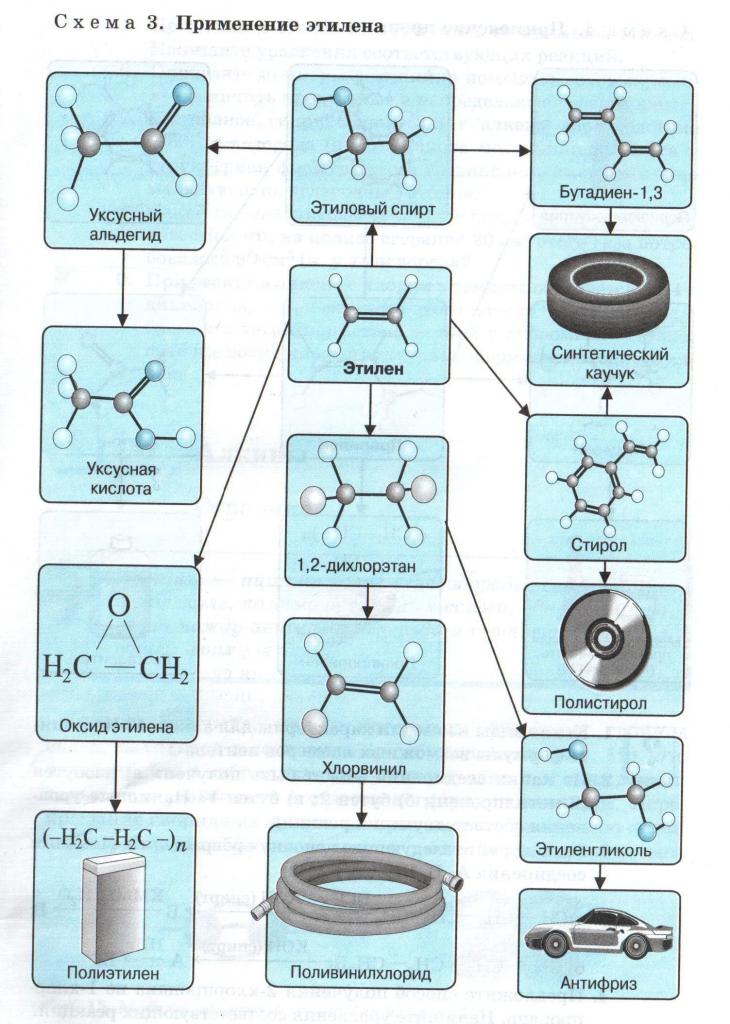
Алкадиены — это алкены с двумя двойными связями в одной молекуле. Основное их применение — производство синтетического каучука, из которого потом изготавливают различные грелки и спринцовки, зонды и катетеры, перчатки, соски и многое другое, что просто незаменимо при уходе за больными.
Применение в промышленности
| Вид промышленности | Что применяют | Каким образом могут использовать |
| Сельское хозяйство | этен | ускоряет созревание овощей и фруктов, дефолиация растений, пленки для теплиц |
| Лако-красочная | этен, бутен, пропен и др. | для получения растворителей, эфиров, сольвента |
| Машиностроение | 2-метилпропен, этен | производство синтетического каучука, смазочные масла, антифриз |
| Пищевая промышленность | этен | производство тефлона, этилового спирт, уксусная кислота |
| Химическая промышленность | этен, полипропилен | получают спирты, полимеры (поливинилхлорид, полиэтилен, поливинилацетат, полиизобтилен, уксусный альдегид |
| Горная промышленность | этен и др. | взрывчатые вещества |
Более широкое применение нашли алкены и их производные в промышленности. (Где и как используются алкены, таблица выше).

Это лишь малая часть использования алкенов и их производных. С каждым годом потребность в олефинах только возрастает, а значит, возрастает потребность и в их производстве.
(Ответ: бутен-2.)


























