Рассмотрим основные химические формулы веществ. Принято выделять смеси и чистые вещества. Если первые предполагают наличие нескольких компонентов, каждый из которых сохраняет индивидуальные свойства, то чистые вещества не предполагают присутствия каких-либо примесей. Проанализируем основные химические формулы для решения задач, предлагаемые выпускникам основной и средней школы.

Классификация
Начнем с того, что существует подразделение соединений на простые и сложные вещества. Основные химические реакции, рассматриваемые в курсе химии 8-9 класса, касаются воды, кислорода, водорода. Остановимся на них подробнее.
Вода
Рассматривая основные химические формулы, нельзя оставить без внимания то соединение, без которого невозможно существование человека. Н2О - эту формулу знают не только старшеклассники, но и ребята из начальной школы. В составе молекулы два атома водорода и один атом кислорода, соединенные между собой ковалентной полярной химической связью.
Вода необходима для протекания обменных процессов, она является активным соединением, взаимодействующим с простыми и сложными органическими и неорганическими веществами.

Кислород
Изучая основные химические формулы в рамках школьной программы, обязательным является рассмотрение О2. Это простое вещество с ковалентной неполярной связью, образованное двумя атомами водорода, необходимо живым существам для дыхания. Молекулярный кислород принимает активное участие и в реакциях горения, образуя с белками, жирами, углеводами несколько продуктов: оксид углерода (4) и воду.
Основные химические реакции при горении предельных и непредельных углеводородов являются базой для оставления расчетных задач. Приведем один из примеров из курса 10 класса органической химии. Предположим, необходимо определить объем газа, который требуется для полного сгорания 30 литров газообразного метана. Для того чтобы справиться с поставленной задачей, сначала записывается уравнение протекающего взаимодействия, расставляются коэффициенты:
СН4+2О2=СО2+2Н2О
Далее составляется пропорция с учетом того, что по закону Авогадро мольные отношения будут равны объемным. Далее проводятся математические расчеты.

Серебро
Анализируя простые вещества, необходимо подробнее остановиться на некоторых из них. В частности, интерес представляет такой металл как серебро. Издавна он привлекал людей своим блеском, незначительной реакционной способностью. На протяжении нескольких веков именно серебро применялось для обеззараживания питьевой воды. Данный метод лег в основу создания современных бытовых фильтров, предназначенных для удаления микроорганизмов из питьевой воды. В природе он находится в виде самородков. Так, есть упоминания о том, что в XV веке на руднике «Святой Георгий» был найден самородок серебра, вес которого составлял 20 тонн.
В природе есть серебряные руды (в которых порядка 50% самого металла), а также полиметаллические комплексные составы (в них серебра не более 15%). Подобные руды есть в Японии, Боливии, США, Перу, Австралии, Канаде.
Это пластичный металл серебристого белого цвета (с высокой электрической проводимостью) имеет бактерицидные свойства. В нашей стране ПДК серебра в питьевой воде установлен нормами Санитарно-гигиенического контроля, он составляет 0,05 мг/л. В средние века данному металлу придавали магические свойства: защиту от злых сил, вампиров, демонов. Если на человеке серебряные изделия темнели, считалось, он неизлечимо болен. Этот металл используют в электронике, ювелирном деле, фотографии, электротехнике, медицине.

Серная кислота
Рассматривая основные химические формулы неорганических веществ, которые должны знать школьники, нельзя оставить без внимания эту кислородсодержащую кислоту. Исходным сырьем для ее производства является пирит (FeS2), сероводород (H2S), кристаллическая сера (S). В настоящее время в химической промышленности используется ступенчатое получение данной кислоты. Сначала окисляется до печного газа (оксида серы 4) исходное сырье, затем оно окисляется до оксида серы (6), затем происходит гидратация.
В пищевой промышленности она используется в качестве добавки Е513. Выступая в виде эмульгатора, серная кислота применяется в производстве напитков (регулирует кислотность). Также Е513 является составным компонентом минеральных удобрений. В органическом синтезе серная кислота выступает катализатором различных реакций: гидратации, дегидрирования, алкилирования.
В домашних условиях H2SO4 выступает электролитом для автомобильных аккумуляторов. При работе с ней важно соблюдать правила осторожности, так как серная кислота является едким химическим веществом.

Сульфаты
Анализируя основные химические формулы неорганических соединений, необходимо уделить отдельное внимание солям серной кислоты. Сульфат магния, к примеру, обладает слабительным эффектом. Его вводят в качестве спазмолитика больным в случае гипертонической болезни, а также для улучшения отвода желчи. Также MgSO4 имеет противосудорожный эффект.
Тиосульфат натрия — лекарственное средство, являющееся противоядием для свинца, цианидов, галогенов, ртути.
Вместе с соляной кислотой тиосульфат натрия применяется для лечения различных дерматологических болезней. К примеру, эти препараты востребованы для лечения чесотки.

Углеводы
В рамках школьной программы рассматриваются основные химические формулы органических соединений. Остановимся лишь на некоторых из них. В частности, глюкоза имеет молекулярную формулу С6Н12О6. Данное вещество относится к классу углеводов (моносахарид), обладает качественными реакциями на альдегидную группу, содержащуюся в молекуле: «серебряного зеркала», «игры цветов».
Этот моносахарид необходим для клеток головного мозга, а также для эритроцитов крови. В случае малоподвижного образа жизни потребность в ней у человека понижается.
Органические кислоты
Основные формулы химических элементов, рассматриваемые в курсе старшей школы, дают представление о многогранности органической химии. В частности, гиалуроновая кислота — это один из важнейших строительных материалов внеклеточного пространства соединительных тканей – матрикса – это гликозаминогликаны, к которым относится гиалуроновая кислота (гиалуронан). Благодаря этому веществу ткани обеспечены функцией антисжатия: гиалуронан впитывает большой объем воды, становится гелеобразным веществом, препятствует процессу набухания.
Гиалуроновая кислота позволяет питательным компонентам свободно распространяться по всем тканям. Она есть в составе большинства растворов, предназначенных для косметических уколов. Данное вещество способствует укреплению, разглаживанию кожного покрова, запуску регенерации клеток дермы.
В косметологии применяют гиалуроновые инъекции, питающие клетки кислородом, повышающие защитные способности кожи, выводящие токсичные вещества, повышающие пластичность кожного покрова, нормализующие водный баланс.
Синтетическая молочная кислота
Это вещество выделяется в мышечных тканях во время продолжительной физической активности. В салонах красоты используют синтетическую молочную кислоту, что минимизирует вероятность развития аллергии. Препараты, в которых активным веществом является молочная кислота, способствует приданию формы щекам, скулам, разглаживанию складок вблизи носа и губ, избавлению от глубоких морщин.
Процедура занимает не больше 30 минут. Проводится очищение кожи от загрязнений, наносится антисептик, вводятся инъекции, затем косметолог делает массаж обрабатываемой области. Нельзя обрабатывать синтетической молочной кислотой область лба, губ, глаз. Противопоказаны подобные процедуры беременным женщинам, подросткам, а также людям, имеющим болезни кровеносной системы.

Характеристика гликолевой кислоты
Гликолевая кислота относится к разряду фруктовых или альфа-гидроксильных кислот. В природе содержится в винограде, сахарной свекле, сахарном тростнике. HOOC-CH2-OH — это простейшая гидроксикислота. Бесцветные кристаллы с запахом жженого сахара, они хорошо растворяется вводе, спирте, диэтиловом эфире.
Косметика с гликолевой кислотой особенно часто применяется подростками при уходе за жирным типом эпидермиса, так как дает возможность избавиться от сального блеска, сузить поры и устранить акне. Чем больше активность сальных желез, тем выше должна быть концентрация данного активного вещества в составе средства. Гликолевая кислота подходит для борьбы с небольшими воспаленными участками на коже, эксфолиации рогового слоя эпидермиса, включая и сверхчувствительную кожу.
Расчетные задачи
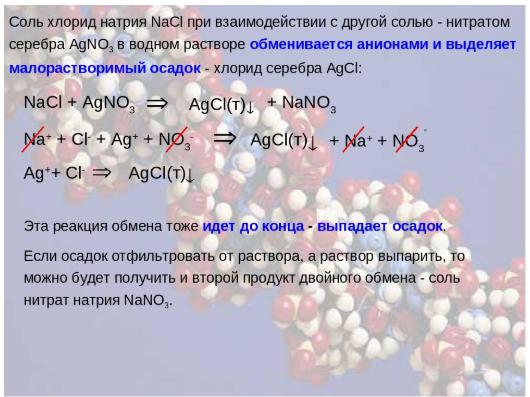
Основные химические формулы для решения задач по химии, которые предлагаются девятиклассникам на итоговом экзамене по химии, связаны с разными типами химических реакций. Приведем конкретный пример. Необходимо определить массу осадка, образующегося при взаимодействии 100 граммов раствора с массовой долей 10% с избытком поваренной соли.
Для того чтобы справиться с подобным заданием, сначала нужно определить массу вещества через пропорцию. Далее составляется уравнение реакции взаимодействия между хлоридом натрия и нитратом серебра. Пользуясь периодической системой химических элементов Д. И. Менделеева, определяются молярные массы веществ, затем их массы с учетом коэффициентов. Последним действием является решение пропорции, определение массы осадка, в качестве которого выступает хлорид серебра.
Важные моменты
Основные химические формулы веществ и их названия — это вопросы, которые включены в задания ОГЭ и ЕГЭ. Ребята должны владеть терминологией, уметь выделять простые и сложные соединения, определять принадлежность соединений к одному из классов неорганических (органических) веществ.
Подведем итоги
В настоящее время существует множество веществ, которые рассматриваются в рамках школьного курса химии. К примеру, в 8-9 классах особое внимание уделяется рассмотрению следующих классов неорганических веществ: кислот, оснований, оксидов, солей. В старшей школе в рамках органической химии анализируются спирты, карбоновые кислоты, альдегиды, углеводы, жиры, различные классы углеводородов.
Типичные представители каждого класса органических и неорганических соединений встречаются также и в расчетных задачах, типы которых изучаются не только на уроках химии, но и в рамках факультативных занятий (во внеурочное время).



























