Все неорганические вещества делятся на простые соединения: металлы; неметаллы. И сложные: бинарные соединения; основания; кислоты; соли.
Как располагаются неметаллы в таблице Менделеева? Из 118 известных на данный момент химических элементов 96 являются металлами, и только 22 относятся по общей характеристике элементов к неметаллам. На долю неметаллических химических элементов приходится большая часть массы живых организмов. А в состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
Расположение неметаллических элементов в Периодической системе

В короткопериодном варианте – в главных подгруппах -неметаллы. Общую характеристику рассмотрим ниже. Неметаллы расположены правее и выше диагонали Бора и Астата. В длиннопериодном варианте – в конце справа в группах IVA, VA, VIA, VIIA, VIIIA.
Из всех открытых на сегодняшний день химических элементов неметаллических элементов немного – всего 22. Из них 16 активных элементов и 6 инертных газов. Однако химия неметаллов богаче, чем химия всех металлов. Неметаллические элементы играют огромную роль в существовании жизни на Земле.
Общая характеристика неметаллов
Атомы неметаллических элементов содержат на внешнем уровне от четырех до семи электронов и по восемь электронов у инертных газов, за исключением водорода (один электрон) и гелия (2 электрона). Поэтому в общей характеристике строения атомов неметаллов - это способность и принимать и отдавать электроны, играя роль как окислителей, так и восстановителей.
Таким образом, в соединениях неметаллические элементы проявляют как отрицательные, так и положительные степени окисления. Характерные значения валентности и степени окисления неметаллов связаны со строением их внешнего электронного уровня
Так, например, сера может проявлять валентность 2, 4, 6 за счет разъединения электронов. В природе неметаллы, кроме кислорода, азота, водорода, серы и инертных газов, существуют в виде соединений: сульфидов, оксидов, хлоридов, силикатов, сульфатов, карбонатов, фосфатов различных металлов.
Неметаллические элементы в свободном виде существуют в виде простых веществ – неметаллов. Рассмотрим их строение, свойства и применение. Атомы неметаллов связаны между собой ковалентной связью. Формы существования неметаллов различны. Водород, иод, хлор, фтор, бром, существуют только в виде двухатомных молекул H2, I2, Cl2, F2 Br2. Причина состоит в том, что у них есть только одна возможность образовать общую пару за счет единственного неспаренного электрона.
Аллотропия неметаллов
С увеличением числа неспаренных электронов для элементов появляется возможность образования простых веществ разного состава – аллотропных видоизменений. Так, кислород образует две аллотропных модификации.
Водород H2, фтор F2, хлор Cl2, азот N2, кислород O2, озон O3 – довольно легкие неполярные молекулы, которые слабо взаимодействуют друг с другом. Поэтому все перечисленные вещества – газы при обычной температуре.
Бром Br2 – жидкость, а I2 – твердое вещество. В твердом виде все они имеют молекулярную кристаллическую решетку.
Методы получения
Первым пунктом общей характеристики неметаллов можно считать методы их получения. Неметаллы получают различными способами:
- Отделением от других веществ из природных соединений. Например, разделение жидкого воздуха на кислород, азот и остаточные инертные газы.
- Восстановлением из соединения, если неметалл в нем имеет положительную степень окисления. Например, восстановление водорода из воды электролизом: +1 –2 0 Катод (-) 2H2O + 2е = H2+ 2OH-.
- Окислением из соединения, в котором неметалл имеет отрицательную степень окисления. Например, окисление хлорид-ионов при электролизе раствора или расплава хлорида натрия: Анод (+) 2Cl- - 2е = Cl02↑.
Также различают промышленные и лабораторные способы получения неметаллов.
Физические свойства
Второй пункт общей характеристики неметаллов - их физические свойства. В основном неметаллы обладают атомной или молекулярной кристаллической решеткой. Часть из них хорошо проводят электрический ток, либо являются полупроводниками. Третий пункт в изучении общей характеристики неметаллов состоит в рассмотрении их химических свойств.
Неметаллы могут служить в химических реакциях, как окислителями, так и восстановителями. Исключение составляет фтор F2, который всегда играет роль окислителя. Поэтому все реакции с участием неметаллов являются окислительно-восстановительными.
Рассмотрим отношение неметаллов к воде, металлам, друг к другу, а также к оксидам, кислотам, основаниям и солям. Все неметаллы устойчивы к нагреванию, поэтому большинство их реакций проходит только при высоких температурах:
1. С водой при обычных условиях активно взаимодействует только фтор: F2 + H2O = 2HF + O 2O = O2; O2 + O = O3. Можно сказать, что вода горит во фторе. При этом образуется сложная смесь веществ, в том числе фториды кислорода OF2 и O2F2. Хлор и бром взаимодействуют с водой только частично: Cl2 + H2O ←→ HCl + HClO Растворы хлора Cl2 в воде называют хлорной водой. При пропускании водяного пара над нагретым углем образуется водяной газ: C + H2O =to CO + H2.
2. С металлами взаимодействуют все неметаллы, кроме инертных газов. В результате образуются бинарные соединения: оксиды, гидриды, карбиды, нитриды, фосфиды, сульфиды, хлориды, бромиды, иодиды и др. Ca + H2 = CaH2 – гидрид кальция.
3. Друг с другом неметаллы реагируют только при нагревании (кроме фтора), образуя бинарные соединения разного типа:
- Оксиды: N2 + O2 ←→ 2NO –Q – оксид азота (II) Из неметаллов непосредственно с кислородом не реагируют только хлор, бром, иод. Их оксиды получают косвенным путем.
- Водородные соединения: H2 + S = H2S – сероводород.
4. С оксидами при обычных условиях неметаллы практически не реагируют. При нагревании происходят немногочисленные, но практически важные реакции. Например, восстановление металлов и неметаллов из оксидов: FeO + C = Fe + CO↑.
Рассмотрим общую характеристику неметаллов на примере галогенов

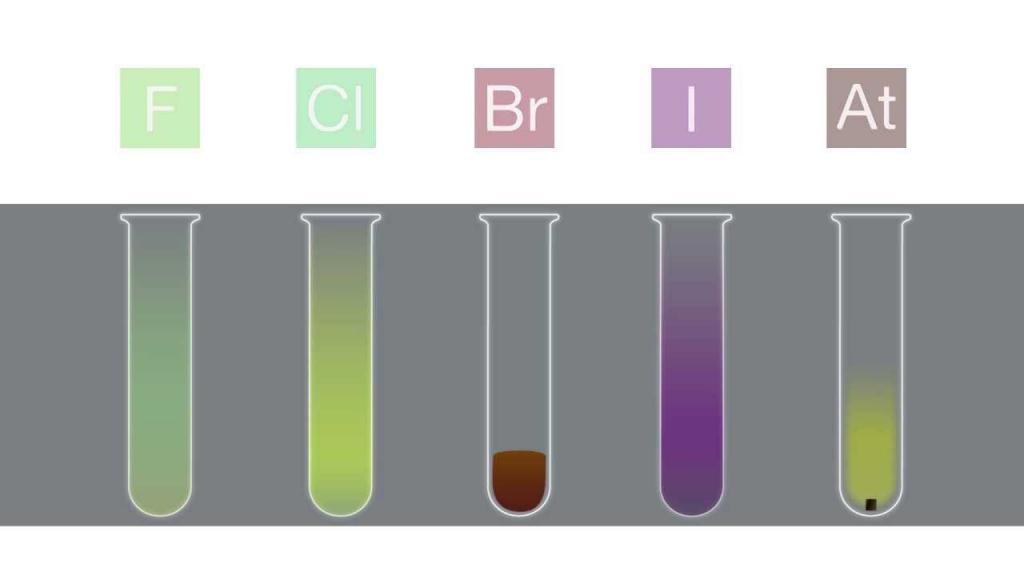
Фтор F2 и хлор Cl2 проявляют сходные физические свойства: это ядовитые газы с резким запахом, причем фтор имеет светло-желтый цвет, а хлор – желто-зеленый. Бром Br2 – тяжелая жидкость красно-бурого цвета. Хлор и бром частично растворимы в воде, их раствор называют хлорной и бромной водой.
Иод I2 – очень мало растворим в воде, лучше растворяется в спирте или других органических растворителях.
Галогены получают путем электролиза расплава или раствора NaCl или вытеснением их хлором. Галогены вытесняют друг друга из растворов их кислот: 2HBr + Cl2 = 2HCl + Br2.



























