Ферменты — это белки, которые помогают ускорить обмен веществ или химические реакции в нашем организме. Ферменты необходимы для улучшения процесса пищеварения и подержания функции печени. Ферменты являются биокатализаторами, т.е. веществами биологического происхождения, ускоряющими химические реакции
Ферменты представляют собой биологические катализаторы белковой природы. Они играют ключевую роль в обмене веществ, ускоряя химические реакции в живых организмах. Без участия ферментов большинство биохимических процессов протекали бы чрезвычайно медленно.
По химической природе все ферменты являются белками. Однако существуют существенные различия в их строении, определяющие особенности механизма действия.
Далее мы подробно рассмотрим классификацию ферментов по строению, изоферменты, а также структуру их активных и аллостерических центров.
Разделение ферментов на простые и сложные
По химической природе все ферменты являются белками. Они подразделяются на простые и сложные. Простые ферменты при гидролизе расщепляются до аминокислот. К простым относятся такие ферменты, как трипсин, уреаза, рибонуклеаза.
Большинство природных ферментов относится к сложным белкам. Помимо белковой части, называемой апоферментом, они содержат небелковый компонент – кофактор. Апофермент и кофактор в отдельности не проявляют ферментативной активности. Активная молекула фермента (холофермент) образуется при их соединении.
Кофакторы бывают неорганической и органической природы. Неорганические представлены ионами металлов, например цинка, магния, железа, меди. Органические кофакторы называют коферментами. Многие из них содержат остатки водорастворимых витаминов.
Мономерные и олигомерные ферменты
Ферменты могут быть как мономерными, так и олигомерными. Мономерные ферменты состоят из одной полипептидной цепи и имеют первичную, вторичную и третичную структуры. К таким относятся, например, рибонуклеаза и трипсин.
Олигомерные ферменты включают 2 и более полипептидных цепей (субъединиц). Помимо первичной, вторичной и третичной структур, они обладают еще и четвертичной структурой. Чаще всего встречаются олигомерные ферменты с четным числом субъединиц, такие как лактатдегидрогеназа (4 субъединицы) и уреаза (8 субъединиц).
Если олигомерные ферменты, состоящие из разных субъединиц, катализируют последовательные реакции обмена веществ, то они образуют мультиферментные комплексы. Например, пируватдегидрогеназный комплекс, участвующий в окислении пировиноградной кислоты, включает 3 разных фермента.
Изоферменты и их биологическая роль
Одним из хорошо изученных примеров олигомерных ферментов является лактатдегидрогеназа (ЛДГ). Этот фермент состоит из 4 субъединиц и катализирует обратимое превращение пировиноградной кислоты в молочную.
ЛДГ существует в виде 5 изоферментов - разновидностей этого фермента с одинаковой каталитической активностью. Изоферменты ЛДГ образуются в результате разного сочетания двух типов субъединиц: Н-типа (сердечного) и М-типа (мышечного). Например, изофермент ЛДГ1 состоит из 4Н субъединиц, а ЛДГ5 - из 4М субъединиц.
Для каждого органа или ткани характерно определенное соотношение изоферментов ЛДГ. Это связано с особенностями обмена веществ в разных тканях. Например, в сердце преобладает ЛДГ1, а в печени - ЛДГ5. Поэтому анализ изоферментного спектра используется в клинической диагностике для выявления патологий.
Структура активного центра ферментов
По химической природе ферменты являются белками. У них есть специальный участок - активный центр, ответственный за связывание субстрата и осуществление химической реакции. Активный центр занимает лишь небольшую часть всей молекулы фермента.
Активный центр представляет собой трехмерное образование, структура которого стереохимически комплементарна (соответствует) структуре субстрата. Это определяет специфичность фермента и природу катализируемой им химической реакции. Комплементарность обеспечивается строго определенным расположением функциональных групп аминокислотных остатков, называемых каталитическими.
Структура некоторых активных центров нежесткая и принимает форму, комплементарную субстрату, только после его связывания. Этот процесс называется «индукцией соответствия».
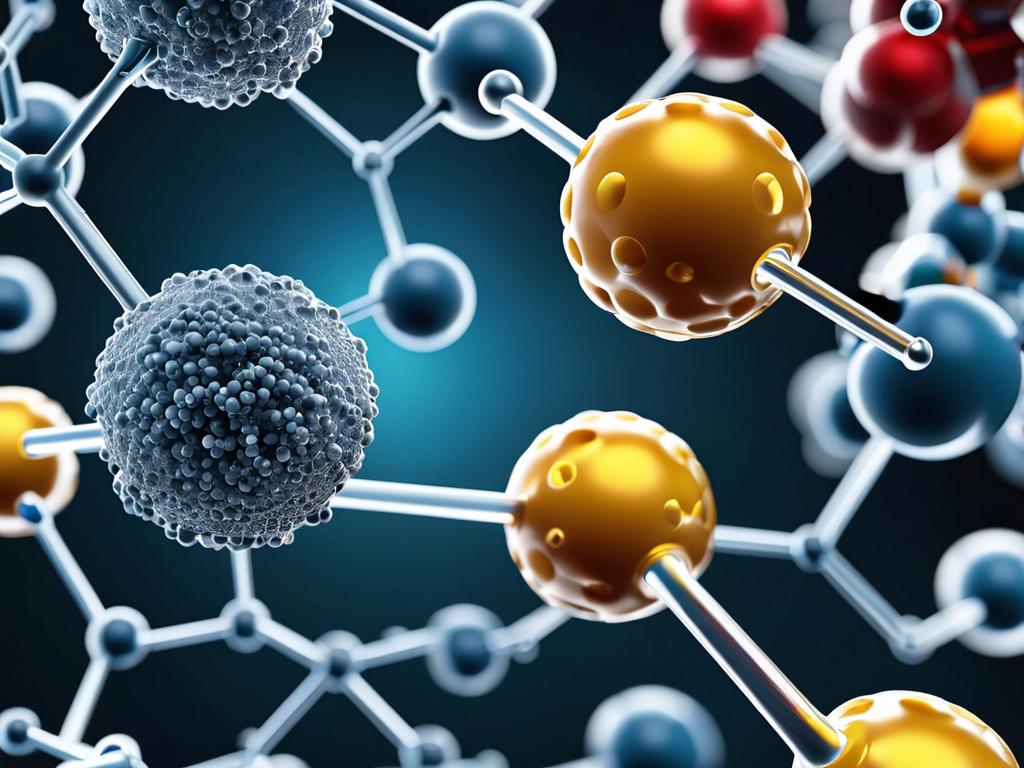
Аллостерический центр и эффекторы
Помимо активного центра, в их молекуле часто присутствует аллостерический центр. Это участок, пространственно удаленный от активного центра и связывающий аллостерические эффекторы.
В качестве эффекторов могут выступать различные химические вещества, чаще всего гормоны. Положительные эффекторы-активаторы повышают активность фермента. Отрицательные эффекторы-ингибиторы, наоборот, снижают ее.
Присоединение эффектора к аллостерическому центру изменяет пространственную структуру фермента, в том числе активного центра. Это приводит к изменению каталитической активности фермента.
Каталитические механизмы ферментов
По химической природе ферменты являются белками, обладающими каталитической активностью. Они ускоряют химические реакции в живых организмах благодаря различным механизмам.
Одним из распространенных механизмов является ковалентная модификация субстрата. Фермент временно образует ковалентную связь с субстратом, что приводит к изменению его химических свойств и ускорению реакции. Например, химотрипсин ковалентно связывает аминокислотные остатки в белке, расщепляя его.
Другой важный механизм - кислотно-основной катализ. Ионизируемые группы фермента изменяют кислотно-основные свойства функциональных групп субстрата, облегчая протекание реакции. Так действует, к примеру, карбоангидраза в реакции гидратации СО2.
Кофакторы и их роль
По химической природе ферменты являются белками. Многие из них, помимо белковой части, содержат небелковый компонент - кофактор. Кофакторы бывают неорганическими и органическими.
К неорганическим кофакторам относят ионы металлов - цинка, магния, железа, меди и др. Они стабилизируют структуру фермента, а также непосредственно участвуют в катализе.
Органические кофакторы называют коферментами. Многие из них содержат остатки витаминов. Коферменты выполняют важные функции при катализе - перенос атомных групп, протонов, образование активного центра.
Регуляция активности ферментов
Активность ферментов в организме строго регулируется. Существует несколько механизмов такой регуляции:
- Регуляция количества фермента путем изменения интенсивности его синтеза или распада
- Влияние на активность фермента эффекторов — активаторов и ингибиторов
- Модификация химической структуры фермента
- Влияние физико-химических факторов — температуры, рН, ионной силы среды
Наиболее распространенный и быстрый способ регуляции активности ферментов — влияние эффекторов, связывающихся с аллостерическим центром фермента. Активаторы повышают, а ингибиторы снижают скорость ферментативной реакции. Чаще всего в качестве регуляторных молекул выступают и продукты метаболизма.
Другой эффективный способ — изменение количества фермента в клетке. Он более медленный, так как требует либо ускорения синтеза белка на уровне транскрипции и трансляции, либо усиления распада фермента. Так клетка адаптируется к длительным изменениям внешних условий и потребностям организма.
Таким образом, благодаря разным механизмам регуляции активности, в живой клетке поддерживается оптимальная скорость всех ферментативных реакций в соответствии с текущим функциональным состоянием организма.
Ингибиторы ферментов
Ингибиторы представляют собой вещества, которые снижают активность ферментов. Различают несколько типов ингибирования в зависимости от механизма действия ингибитора:
- Конкурентное ингибирование - ингибитор конкурирует с субстратом за связывание с активным центром фермента. Этот процесс обратим.
- Неконкурентное ингибирование - ингибитор связывается с аллостерическим центром фермента, вызывая конформационные изменения, которые препятствуют связыванию субстрата с активным центром.
- Необратимое ингибирование - происходит ковалентная модификация фермента, делающая его неактивным.
Ингибиторы широко применяются в медицине в качестве лекарственных препаратов. Например, ингибиторы используются для лечения гипертонии, язвенной болезни, ВИЧ и других заболеваний. В пищевой промышленности ингибиторы применяются для предотвращения нежелательных ферментативных реакций, приводящих к порче продуктов.
Природные ингибиторы присутствуют в клетках живых организмов и выполняют регуляторную функцию. Они позволяют быстро и обратимо подавлять активность ферментов при необходимости. Ключевую роль играют ингибиторы протеолитических ферментов, предотвращающие нежелательный гидролиз белков в клетке.
Таким образом, использование ингибиторов дает возможность эффективно регулировать скорость ферментативных реакций как в живых организмах, так и в различных отраслях промышленности. Понимание механизмов ингибирования помогает целенаправленно подбирать ингибиторы для конкретных практических задач.
Применение ферментов
Благодаря своей высокой каталитической активности и специфичности, ферменты находят широкое применение в различных областях:
- Пищевая промышленность. Ферменты используются при производстве сыров, йогуртов, пива, вина и других продуктов для управления биохимическими процессами брожения, созревания.
- Фармацевтическая промышленность. Применяются для получения антибиотиков, витаминов, гормонов, лекарственных средств.
- Бытовая химия. Ферменты входят в состав моющих средств для усиления очищающего действия.
- Медицина. Ферменты используются для диагностики заболеваний, в ферментной терапии.
- Научные исследования. Ферменты применяются в молекулярной биологии, генной инженерии, биотехнологии для анализа и модификации биополимеров.
Особенно актуально использование иммобилизованных ферментов. Это ферменты, закрепленные на инертном носителе, сохраняющие при этом каталитическую активность. Преимущества иммобилизованных ферментов:
- Возможность многократного использования
- Упрощение отделения фермента от реакционной среды
- Улучшение стабильности фермента при хранении и в неблагоприятных условиях
В промышленности иммобилизованные ферменты позволяют организовать непрерывные ферментативные процессы в биореакторах. В медицине применяются в биосенсорах для экспресс-диагностики различных веществ по их воздействию на иммобилизованный фермент.
Таким образом, ферменты активно используются в самых разных областях благодаря своей высокой эффективности и специфичности. Особенно перспективно дальнейшее применение иммобилизованных ферментов, поскольку это позволяет максимально эффективно использовать их каталитический потенциал.
Ферменты в клинической диагностике
Определение активности ферментов и их изоферментов в биологических жидкостях человека является важным диагностическим тестом в медицине. Это связано с тем, что при многих патологических состояниях происходит выход ферментов в кровь, мочу и другие биологические жидкости.
Наиболее часто определяют следующие ферменты:
- Повышение уровня свидетельствует о поражении печени
- Креатинкиназа - маркер повреждения миокарда и скелетных мышц
- Лактатдегидрогеназа - неспецифический маркер цитолиза
- Щелочная фосфатаза - маркер заболеваний костей и печени
- Амилаза - маркер панкреатита
Определение изоферментных спектров также несет важную диагностическую информацию. Например, преобладание в крови изофермента ЛДГ1 указывает на заболевание сердца, а ЛДГ5 - печени.
Кроме того, ферменты могут определяться непосредственно в биоптатах тканей для уточнения характера патологического процесса. Иммуногистохимическое определение ферментов позволяет выявлять онкологические заболевания.
Таким образом, исследование ферментов является одним из ключевых методов лабораторной диагностики. Оно позволяет получить ценную информацию о локализации, характере и стадии патологического процесса, что необходимо для постановки диагноза и контроля за эффективностью лечения.
Получение и очистка ферментов
Для практического применения ферментов необходимо получать их в достаточном количестве и очищать до высокой степени. Существуют следующие основные методы получения ферментов:
- Выделение из природных источников (растений, животных, микроорганизмов). Этот традиционный подход имеет ограничения по объемам получения ферментов.
- Микробиологический синтез с использованием бактерий или дрожжей-продуцентов. Позволяет получать ферменты в промышленных масштабах.
- Химический синтез. Применяется для получения относительно простых.
- Генно-инженерные методы. Дают возможность экспрессировать ферменты в клетках микроорганизмов, растений и животных с заданными свойствами.
После получения сырого ферментного препарата проводят его очистку методами: ионнообменной и гель-хроматографии, электрофореза, ультрафильтрации, кристаллизации. Это позволяет выделить фермент в electrophoretically гомогенном виде с высокой активностью.
Для иммобилизации ферментов на твердый носитель используют различные методы: адсорбцию, ионную сшивку, включение в гель, «захватывание» за счет аффинных взаимодействий. Подбор оптимального метода зависит от природы фермента и условий его дальнейшего применения.
Таким образом, современные методы получения и очистки ферментов позволяют максимально полно использовать их каталитический потенциал в практических целях.
Иммобилизованные ферменты
Иммобилизация ферментов - это их закрепление на поверхности носителя, сохраняющего их каталитическую активность. Этот подход имеет следующие преимущества:
- Возможность многократного использования фермента
- Удобство разделения фермента и продуктов реакции
- Повышенная устойчивость к действию температуры, рН и других факторов
В качестве носителей для иммобилизации используют: ионообменные смолы, целлюлозу, агарозу, полимерные гели, углеродные нанотрубки, мембраны. Выбор носителя зависит от природы фермента и условий его работы.
Для закрепления на носителе применяют такие методы как адсорбция, ионная сшивка, включение в гель, ковалентное связывание. Оптимальный метод подбирают экспериментально.
Иммобилизованные ферменты активно применяются в медицине, пищевой промышленности, очистке сточных вод, биосенсорах. Их использование позволяет интенсифицировать биотехнологические процессы и снизить их стоимость. Дальнейшие исследования в этой области направлены на создание новых высокоэффективных носителей и методов иммобилизации.
Перспективы изучения ферментов
Несмотря на многолетнее изучение, ферменты до сих пор остаются важным объектом исследований в биохимии и смежных областях. Основные направления дальнейшего изучения ферментов:
- Установление пространственной структуры ферментов, в том числе с применением методов рентгеноструктурного анализа и криоэлектронной микроскопии
- Исследование механизмов катализа и регуляции активности ферментов
- Изучение взаимосвязи между структурой и функцией ферментов, в том числе с использованием методов генной инженерии для создания мутантных форм
- Поиск и исследование новых ферментов из различных источников, обладающих уникальными свойствами
- Создание иммобилизованных ферментов и мультиферментных систем с заданными характеристиками
Перспективным является использование компьютерного моделирования для изучения и прогнозирования свойств. Это позволит сократить объемы дорогостоящего натурного эксперимента.
Важнейшей задачей остается поиск ингибиторов ферментов, представляющих интерес в качестве лекарственных средств для лечения социально значимых заболеваний.
Таким образом, несмотря на достигнутые успехи, изучение ферментов продолжает оставаться актуальной и перспективной областью исследований в биохимии и смежных науках.
Заключение
По химической природе ферменты являются белками - сложными макромолекулами, построенными из аминокислот, соединенных пептидными связями. Как биологические катализаторы, ферменты играют ключевую роль в обеспечении жизненных процессов в живых организмах, участвуя практически во всех метаболических реакциях. Благодаря своей специфичности к субстрату и ускорению реакций до 10^20 раз, ферменты позволяют химическим превращениям в организме проходить с высокой скоростью при относительно мягких условиях.
- Ферменты подразделяются на простые (состоят только из белка) и сложные (включают белковый апофермент и небелковый кофактор, например, ионы металлов, коферменты с витаминными остатками).
- Ферменты могут существовать в виде изоферментов - разновидностей одного и того же фермента, катализирующих одну реакцию, но различающихся физико-химическими свойствами.
Уникальная трехмерная структура фермента с активным центром, дополняющим субстрат, лежит в основе его каталитической активности. Присутствие аллостерических центров обеспечивает регуляцию активности ферментов эффекторами-лигандами. Знание механизмов действия ферментов позволяет управлять ферментативными реакциями, разрабатывать новые лекарственные средства и находить применение в биотехнологии.
В заключение отметим, что ферменты, по химической природе являясь белками, играют исключительно важную роль как биоактиваторы многих процессов в живых организмах. Изучение феномена ферментов остается одним из приоритетных направлений современной биохимии.