Фосфор - неметалл, который может проявлять различные степени окисления от -3 до +5. Это обусловлено электронным строением его атома и способностью отдавать или принимать электроны при образовании химических связей. Знание степеней окисления позволяет предсказать свойства соединений фосфора, особенности их получения и применения.
В этой статье мы подробно рассмотрим все известные степени окисления фосфора в соединениях. Проанализируем зависимость между степенью окисления, химическими и физическими свойствами веществ. Разберем на конкретных примерах, как степень окисления влияет на реакционную способность соединений, их получение и применение.
Электронное строение атома фосфора
Атом фосфора имеет порядковый номер 15 в периодической системе Д.И. Менделеева. Это означает, что у него в ядре находится 15 протонов. Соответственно, нейтральный атом фосфора имеет 15 электронов, распределенных по электронным слоям следующим образом:
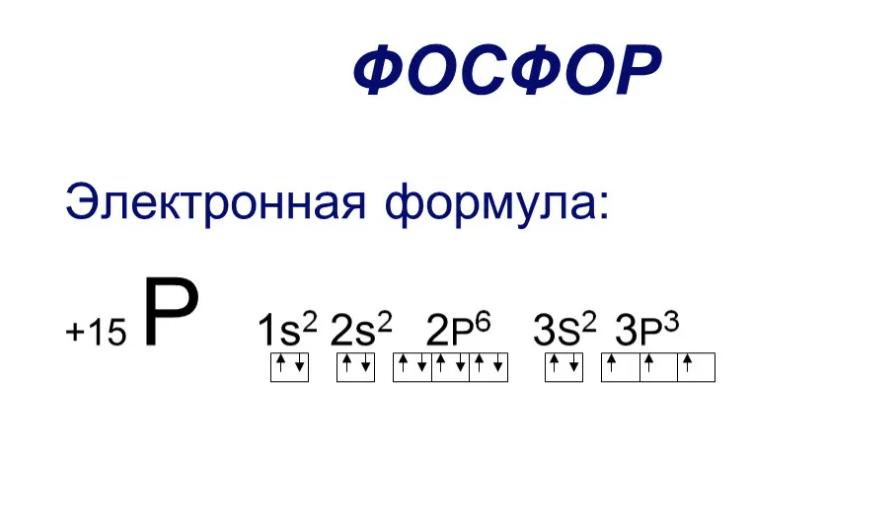
Таким образом, на внешнем энергетическом уровне атом фосфора имеет 3 неспаренных электрона. Эти электроны являются валентными и определяют химические свойства элемента.
Степени окисления фосфора в соединениях могут быть от -3 до +5, что соответствует числу валентных электронов (3s2 3p3). Наиболее распространенные степени окисления: +3 и +5.
- В соединениях со степенью окисления +5 (P2O5, H3PO4 и др.) фосфор отдает все 5 валентных электронов.
- В соединениях со степенью окисления +3 (PCl3, P2O3 и др.) фосфор отдает 3 валентных электрона.
Кислородные соединения фосфора
Кислородные соединения фосфора включают оксиды фосфора с различными степенями окисления.
Наиболее важные оксиды фосфора:
- Оксид фосфора (V) P2O5 - это белый порошок, образуется при сжигании фосфора в избытке кислорода. Является кислотным оксидом, соответствует ортофосфорной кислоте. Фосфор имеет степень окисления +5.
- Оксид фосфора (III) P2O3 - твердое белое вещество, получают при неполном сгорании фосфора. Проявляет основные свойства, соответствует фосфористой кислоте H3PO3. Фосфор имеет степень окисления +3.
Помимо P2O5 и P2O3 существуют нестабильные оксиды фосфора с промежуточными степенями окисления, такие как P4O6, P4O7, P4O8, P4O9, P4O10.
Оксиды фосфора находят применение в производстве фосфорных кислот, фосфатных удобрений, керамики, стекла и других материалов.
Ортофосфорная кислота и ее соли
Ортофосфорная кислота H3PO4 является важнейшим кислородсодержащим соединением фосфора. Она относится к кислотам средней силы и образуется при растворении оксида фосфора(V) P2O5 в воде:

В этой реакции фосфор находится в степени окисления +5, отдавая все пять валентных электронов на образование ковалентных связей с атомами кислорода.
Ортофосфорная кислота - бесцветное кристаллическое вещество, хорошо растворимое в воде. В водных растворах она подвергается постепенной диссоциации с образованием ионов H+ и H2PO4-.
Химические свойства ортофосфорной кислоты:
- - Взаимодействует с металлами, образуя соли - фосфаты (например, с магнием образует фосфат магния Mg3(PO4)2)
- - Взаимодействует с основными оксидами, образуя соли (например, с оксидом кальция образует фосфат кальция Ca3(PO4)2)
- - Взаимодействует с основаниями, образуя соли (например, с гидроксидом натрия образует гидрофосфат натрия Na2HPO4)
Наиболее важные соли ортофосфорной кислоты:
- - Ортофосфаты - соли состава M3(PO4)2, где М - двухвалентный металл
- - Гидрофосфаты - кислые соли состава MHPO4
- - Дигидрофосфаты - соли состава M(H2PO4)2
- - Фосфаты однозамещенные, двузамещенные и трехзамещенные в зависимости от числа атомов водорода, замещенных на металл.
Соли ортофосфорной кислоты широко используются как удобрения в сельском хозяйстве, пищевые добавки, компоненты моющих средств, а также в медицине.






















