Среди огромного разнообразия природных веществ аминокислоты занимают особое место. Оно объясняется их исключительным значением как в биологии, так и в органической химии. Дело в том, что из аминокислот состоят молекулы простых и сложных белков, являющихся основой всех без исключения форм жизни на Земле. Именно по этой причине наука уделяет серьезное внимание изучению таких вопросов, как строение аминокислот, их свойства, получение и применение. Велико значение этих соединений и в медицине, где они применяются в качестве лечебных препаратов. Для тех людей, кто серьезно занимается собственным здоровьем и ведет активный способ жизни, мономеры белков являются одной из форм пищи (так называемое спортивное питание). Некоторые их виды применяются в химии органического синтеза в качестве исходного сырья при производстве синтетических волокон – энанта и капрона. Как видим, аминокарбоновые кислоты играют очень важную роль как в природе, так и в жизни человеческого общества, поэтому познакомимся с ними более подробно.
Особенности строения аминокислот
Соединения этого класса относятся к амфотерным органическим веществам, то есть содержат две функциональные группы, а, значит, проявляют двойственные свойства. В частности, в составе молекул присутствуют углеводородные радикалы, соединенные с аминогруппами NH2 и карбоксильными группами СООН. В химических реакциях с другими веществами аминокислоты выступают то как основания, то как кислоты. Изомерия таких соединений проявляется вследствие изменения или пространственной конфигурации углеродного скелета, или положения аминогруппы, а классификация аминокислот определяется на основании особенностей строения и свойств углеводородного радикала. Он может иметь форму неразветвленной или разветвленной цепи, а также содержать циклические структуры.
Оптическая активность аминокарбоновых кислот
Все мономеры полипептидов, а их 20 видов, представленных в организмах растений, животных и человека, относятся к L-аминокислотам. Большинство из них содержат ассиметричный атом карбона, поворачивающий при вращении поляризованный пучок света влево. Два мономера: изолейцин и треонин - имеют два таких атома углерода, а аминоуксусная кислота (глицин) - ни одного. Классификация аминокислот по оптической активности широко применяется в биохимии и молекулярной биологии при изучении процесса трансляции в биосинтезе белка. Интересно, что D-формы аминокислот никогда не входят в состав полипептидных цепей белков, зато присутствуют в бактериальных оболочках и в продуктах метаболизма грибов-актиномицетов, то есть, по сути, их обнаруживают в природных антибиотиках, например в грамицидине. В биохимии широко известны вещества с D-формой пространственного строения, как цитруллин, гомосерин, орнитин, играющие важную роль в реакциях клеточного метаболизма.
Что такое цвиттер-ионы?
Еще раз напомним, что мономеры белков имеют в своем составе функциональные группы аминов и карбоновых кислот. Частицы -NH2 и СООН взаимодействуют между собой внутри молекулы, что приводит к появлению внутренней соли, называемой биполярным ионом (цвиттер-ионом). Такое внутреннее строение аминокислот объясняет их высокую способность к взаимодействию с полярными растворителями, например с водой. Присутствие же в растворах заряженных частиц обуславливает их электропроводность.
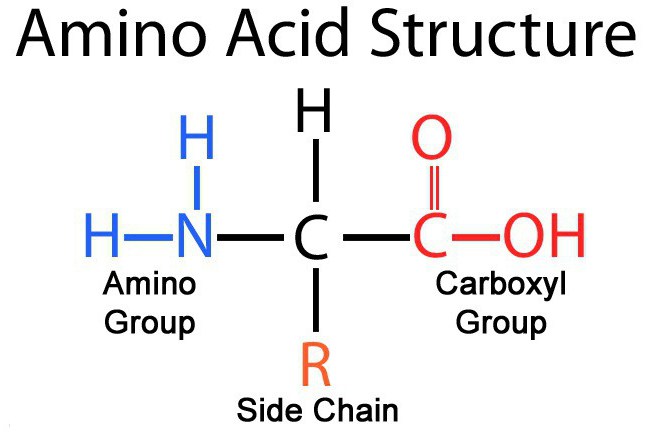
Что представляют собой α–аминокислоты
Если аминная группа расположена в молекуле при первом атоме карбона, считая от места нахождения карбоксила, такую аминокислоту относят к классу α-аминокислот. Они занимают ведущее место в классификации, потому что именно из этих мономеров и построены все биологически активные белковые молекулы, например такие, как ферменты, гемоглобин, актин, коллаген и т. д. Строение аминокислот этого класса можно рассмотреть на примере глицина, того самого, который широко применяют в неврологической практике, как успокоительный препарат при лечении легких форм депрессии и неврастении.

Международное название этой аминокислоты – α-аминоуксусная, она имеет оптическую L-форму и является протеиногенной, то есть участвует в процессе трансляции и входит в состав белковых макромолекул.
Роль белков и их мономеров в обмене веществ
Невозможно себе представить нормальную жизнедеятельность организма млекопитающих, в том числе и человека, без гормонов, состоящих из белковых молекул. Химическое строение аминокислот, входящих в их состав, подтверждает их принадлежность к α–формам. Например, трийодтиронин и тироксин вырабатываются щитовидной железой. Они регулируют обмен веществ и синтезируются в ее клетках из α–аминокислоты тирозина. В простых и сложных белках находятся как 20 основных мономеров, так и их производные. В протромбине, который регулирует свертываемость крови, присутствует карбоксиглутаминовая кислота, в миозине (мышечном протеине) обнаруживается метиллизин, в ферменте пероксидазе – селеноцистеин.
Пищевая ценность белков и их мономеров
Рассматривая строение аминокислот и их классификацию, остановимся на градации, основанной на способности или невозможности белковых мономеров синтезироваться в клетках. Аланин, пролин, тирозин и другие соединения образуются в реакциях пластического обмена, а триптофан и еще семь других аминокислот должны попасть в наш организм только с пищевыми продуктами.
Одним из показателей правильного и сбалансированного питания является уровень потребления человеком белковой пищи. Он должен составлять не менее четвертой части от всего количества еды, поступившей в организм за сутки. Особенно важно, чтобы протеины содержали в своем составе валин, изолейцин и другие незаменимые аминокислоты. В этом случае белки будут называться полноценными. Они поступают в организм человека из растительной пищи или продуктов, содержащих грибы.
Сами же незаменимые мономеры белков не могут синтезироваться в клетках млекопитающих. Если рассматривать строение молекул аминокислот, которые являются незаменимыми, можно убедиться, что они принадлежат к различным классам. Так, валин и лейцин относятся к алифатическому ряду, триптофан – к ароматическим аминокислотам, а треонин - к гидроксиаминокислотам.


























