Все вокруг нас на планете состоит из маленьких, неуловимых для зрения частиц. Электроны – это одни из них. Их открытие произошло относительно недавно. И оно открыло новые представления о структуре атома, механизмах передачи электричества и устройства мира в целом.
Как делили неделимое
В современном понимании электроны – это элементарные частицы. Они являются целостными и не раскалываются на более мелкие структуры. Но такое представление существовало не всегда. До 1897 года об электронах не имели никакого понятия.
Ещё мыслители Древней Греции догадывались о том, что каждая вещь на свете, подобно зданию, состоит из множества микроскопических «кирпичиков». Наименьшей единицей вещества тогда считался атом, и это убеждение сохранялось веками.
Представление об атоме изменились только в конце XIX века. После исследований Дж. Томсона, Э. Резерфорда, Х. Лоренца, П. Зеемана, мельчайшими неделимыми частицами были признаны атомные ядра и электроны. Со временем были открыты протоны, нейтроны, а ещё позже - нейтрино, каоны, пи-мезоны и т. д.
Сейчас науке известно огромное количество элементарных частиц, свое место среди которых неизменно занимают и электроны.

Открытие новой частицы
К моменту, когда были открыты электроны в атоме, ученые давно знали о существовании электричества и магнетизма. Но истинная природа и полные свойства этих явлений до сих пор остаются загадкой, занимая умы многих физиков.
Уже в начале XIX века было известно, что распространение электромагнитного излучения происходит со скоростью света. Однако англичанин Джозеф Томсон, проводя опыты с катодными лучами, заключил, что они состоят из множества мелких крупиц, масса которых меньше атомной.

В апреле 1897 года Томсон выступил с докладом, где и представил научному сообществу рождение новой частицы в составе атома, которую он назвал корпускулой. Позже Эрнест Резерфорд при помощи экспериментов с фольгой подтвердил выводы своего учителя, а корпускулам дали другое название - «электроны».
Это открытие подтолкнуло развитие не только физической, но и химической науки. Оно позволило значительно продвинуться в изучении электричества и магнетизма, свойств веществ, а также дало начало ядерной физике.
Что же такое электрон?
Электроны – это наиболее легкие частицы, обладающие электрическим зарядом. Наши знания о них до сих пор остаются во многом противоречивыми и неполными. Например, в современных представлениях они живут вечно, так как никогда не распадаются, в отличие от нейтронов и протонов (теоретический возраст распада последних превышает возраст Вселенной).
Электроны стабильны и обладают постоянным отрицательным зарядом е=1,6 х 10-19 Кл. Их относят к семье фермионов и группе лептонов. Частицы участвуют в слабом электромагнитном и гравитационном взаимодействии. Они находятся в составе атомов. Частицы, которые потеряли связь с атомами, – свободные электроны.
Масса электронов составляет 9,1 х 10-31 кг и является в 1836 раз меньше массы протона. Они обладают полуцелым и спином, и магнитным моментом. Электрон обозначается буквой "е-". Так же, но со знаком плюс, обозначается его антагонист – античастица позитрон.
Состояние электронов в атоме
Когда выяснилось, что атом состоит из более мелких структур, нужно было понять, как именно они располагаются в нем. Поэтому в конце XIX века появляются первые модели атома. Согласно Планетарным моделям, протоны (положительно заряженные) и нейтроны (нейтральные) составляли атомное ядро. А вокруг него по эллиптическим орбитам двигались электроны.
Эти представления меняются с появлением квантовой физики в начале XX века. Луи де Бройль выдвигает теорию о том, что электрон проявляет себя не только как частица, но и как волна. Эрвин Шредингер создает волновую модель атома, где электроны представляются в виде облака определенной плотности с зарядом.

Точно определить расположение и траекторию движения электронов вокруг ядра практически невозможно. В связи с этим вводится специальное понятие «орбиталь» или «электронное облако», которое является пространством наиболее вероятного расположения названных частиц.
Энергетические уровни
Электронов в облаке вокруг атома ровно столько, сколько и протонов в его ядре. Все они находятся на разном расстоянии. Ближе всего к ядру расположены электроны с наименьшим количеством энергии. Чем больше энергии находится в частицах, тем дальше они могут находиться.
Но располагаются они не хаотично, а занимают конкретные уровни, которые вмещают только определенное число частиц. Каждый уровень обладает своим количеством энергии и разделяется на подуровни, а те, в свою очередь, на орбитали.
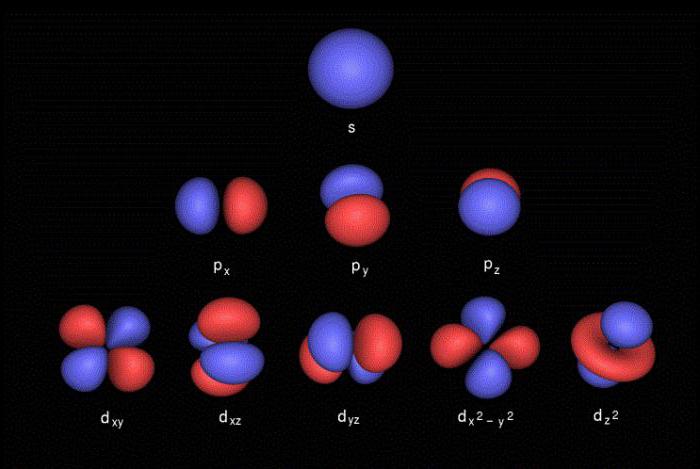
Для описания характеристик и расположения электронов на энергетических уровнях используются четыре квантовых числа:
- n – главное число, определяющее запас энергии электрона (соответствует номеру периода химического элемента);
- l – орбитальное число, которое описывает форму электронного облака (s - сферическая, p – форма восьмерки, d – форма клевера или двойной восьмерки, f – сложная геометрическая форма);
- m – магнитное число, определяющее ориентацию облака в магнитном поле;
- ms – спиновое число, характеризующее обращение электронов вокруг своей оси.
Заключение
Итак, электроны – это стабильные отрицательно заряженные частицы. Они элементарные и не могут распадаться на другие элементы. Их относят к фундаментальным частицам, то есть таким, которые входят в структуру вещества.
Электроны движутся вокруг атомных ядер и составляют их электронную оболочку. Они влияют на химические, оптические, механические и магнитные свойства различных веществ. Эти частицы участвуют в электромагнитном и гравитационном взаимодействии. Их направленное движение создает электрический ток и магнитное поле.


























