В этой статье мы постараемся доступно объяснить, что представляет собой пируватдегидрогеназный комплекс и биохимию процесса, раскрыть состав ферментов и коферментов, обозначить роль и значение данного комплекса в природе и жизни человека. Кроме того, будут рассмотрены возможные последствия нарушения функционального предназначения комплекса и время их проявления.
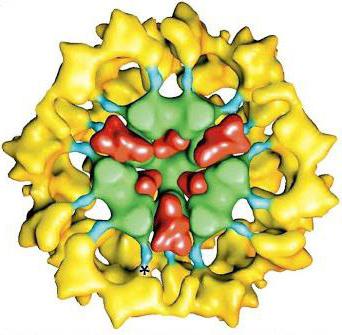
Ознакомление с понятием
Пируватдегидрогеназный комплекс (PDH) – это комплекс белкового типа, роль которого заключается в осуществлении окисления пирувата в результате декарбоксилирования. Данный комплекс содержит в себе 3 фермента, а также два белка, необходимых для осуществления вспомогательных функций. Чтобы пируватдегидрогеназный комплекс мог функционировать, необходимо наличие определенных кофакторов. Их пять: СоА, никотинамидадениндинуклеотид, флавинадениндинуклеотид, тиаминпирофосфат и липоат.
Локализация PDH у бактериальных организмов сосредоточена в цитоплазме, эукариотические клетки хранят его в матриксе на митохондриях.
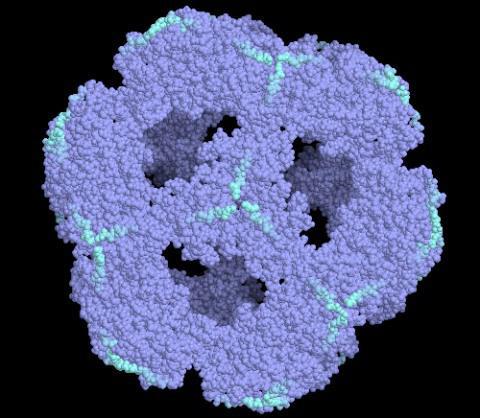
Связь с декарбоксилированием пирувата
Значение пируватдегидрогеназного комплекса заключается в реакции окисления пирувата. Рассмотрим суть этого процесса.
Механизм окисления пирувата под воздействием декарбоксилирования представляет собой процесс биохимической природы, в котором происходит отщепление молекулы CO2 в единственном числе, а далее следует присоединение этой молекулы к пирувату, подвергнутому декарбоксилированию и принадлежащему коферменту А (КоА). Так создается ацетил-KoA. Это явление занимает промежуточное место между процессами гликолиза и цикла кислот трикарбонового типа. Процесс дикарбоксилирования пирувата осуществляется с участием сложного ПДК, который заключает в себе, как было ранее сказано, три фермента и два белка вспомогательного типа.
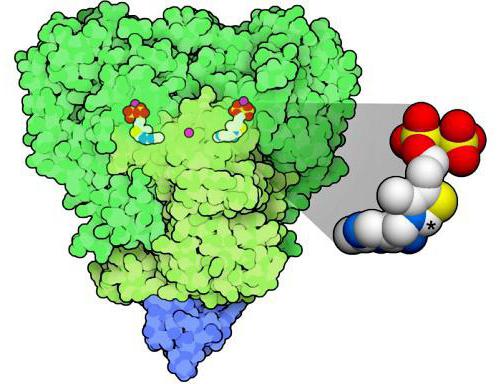
Роль коферментов
Для пируватдегидрогеназного комплекса ферменты играют важнейшую роль. Однако они могут начать свою работу лишь в присутствии пяти коферментов либо групп простетического типа, которые были перечислены выше. Сам процесс приведет в конечном итоге к тому, что ацильная группа будет входить в СоА-ацетил. Говоря о коферментах, необходимо знать, что четыре из них принадлежат к производным витаминам: тиамин, рибофлавин, ниацин и пантотеновая кислота.
Флавинадениндинуклеотид и никотинамидадениндинуклеотид занимаются переносом электронов, а тиаминпирофосфат, многим известный как пируватдекарбоксильный кофермент, вступает в реакции брожения.
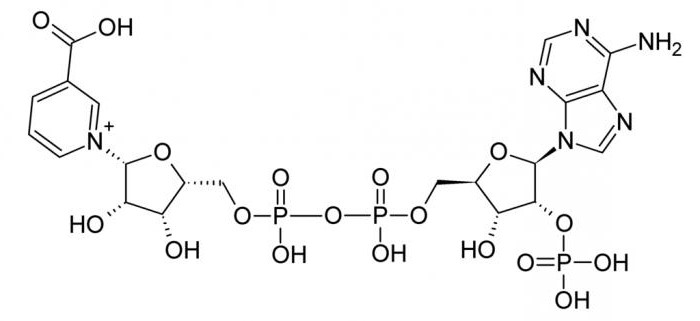
Активация тиольной группы
Кофермент ацетилирования (А) – содержит в себе группу тиольного типа (-SH), которая очень активна, она критически важна и необходима, для того чтобы СоА функционировала в роли вещества, которое сможет переносить ацильную группу в тиольную и образовывать тиоэфир. Сложные эфиры тиолов (тиоэфиры) – имеют достаточно высокий показатель гидролизной энергии свободного характера, потому им присущ высокий потенциал переноса ацильной группы к разнообразным акцепторным молекулам. Именно поэтому ацетил СоА периодически называют активированной СН3СООН.
Перенесение электронов
Помимо четырех кофакторов, имеющих природу производных витаминов, существует 5-й кофактор пируватдегидрогеназного комплекса, именуемый липоатом. Ему присущи 2 группы тиольного типа, способные подвергаться воздействию обратимого окисления, в результате которого образуется связь дисульфидного характера (-S-S-), что схоже с тем, как этот процесс протекает между аминокислотыцистеинными остатками в белках. Умение окисляться и восстанавливаться дает липоату возможность быть переносчиком не только ацильной группы, но и электронов.
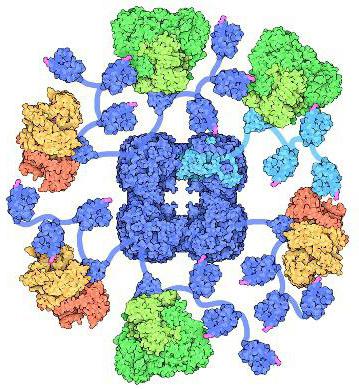
Ферментативный набор
Из ферментов пируватдегидрогеназный комплекс включает в себя три основных компонента. Первым ферментом является пируватдегидрозеназа (Е1). Второй фермент – это дигидролипоилдегидрогеназа (Е3). Третий – дигидролипоилтрансацетилаза (Е2). Пируватдегидрогеназный комплекс включает в себя данные ферменты, храня их в большом количестве копий. Количество копий каждого фермента может быть разным, а потому и размеры комплекса могут сильно варьироваться. PDH комплекс у млекопитающих достигает около 50 нанометров в диаметре. Это больше диаметра рибосомы в 5-6 раз. Такие комплексы очень большие, поэтому их можно различить в электронном микроскопе.
Грамположительная бактерия bacillus stearothermophilus в своем PDH имеет шестьдесят одинаковых копий дигидролипоилтрансацетилазы, которые, в свою очередь, создают додекаэдр пентагонального типа, диаметром, приблизительно равным 25 нанометрам. Грамположительная бактерия Escherichia coli содержит в себе двадцать четыре копии Е2, кот. присоединяет к себе простетическую группу липоата, а она устанавливает связь амидного типа с аминогруппой остатка лизина, входящего в Е2.
Дигидролипоилтрансацетилаза строится при взаимодействии 3 доменов, имеющих функциональные различия. Это: аминотерминальный липоильный домен, содержащий в себе лизина остаток и связанный с липоатом; связывающий домен (центральный Е1- и Е3-); внутренний ацилтрасферазный домен, включающий в себя ацилтрансферазные центры активного типа.
Пируватдегидрогеназный комплекс дрожжей имеет в себе только один домен липоильного типа, млекопитающие таких доменов имеют два, а бактерия кишечной палочки – три. Линкерная последовательность аминокислот, которые состоят из двадцати-тридцати аминокислотных остатков, разделяет Е2, при этом остатки аланинов и пролинов перемежаются с остатками аминокислот, которые заряжены. Эти линкеры чаще всего имеют протяженные формы. Такая особенность влияет на то, что они разделяют 3 домена.
Взаимосвязь происхождения
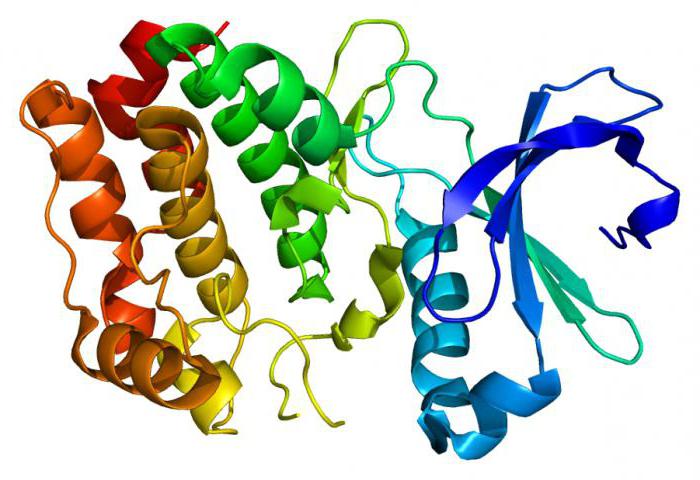
Е1 своим активным центром устанавливает связь с ТТР, а активный центр E3 – с FAD. Человеческий организм фермент Е1 содержит в форме тетрамера, который складывается из четырех субъединиц: двух E1альфа и двух E1бета. Регуляторные белки представлены в виде протеинкиназы и фосфопротеинфосфатазы. Этот тип структуры (Е1- Е2- Е3) остается элементом консерватизма в эволюционном учении. Комплексы с подобным строением и устройством могут участвовать в разнообразных реакция, отличных от стандартных, например, при подвергании окислению α-кетоглутарата на протяжении действия цикла Кребса, также окисляется и α-кетокислота, что образовалась из-за катаболических утилизаций аминокислот разветвленного типа: валина, лейцина и изолейцина.
Пируватдегидрогеназный комплекс имеет фермент E3, встречающийся и в других комплексах. Сходство белковой структуры, кофакторов и также реакционных механизмов указывает на общее происхождение. Липоат прикрепляется к лизину E2, и создается подобие «руки», что способна передвигаться от активного центра Е1 до активных центров Е2 и Е3, что составляет приблизительно 5 нм.
Эукариоты в пируватдегидрогеназном комплексе содержат по двенадцать субъединиц Е3ВР (Е3 – связывающего белка некаталитической природы). Местоположение этого белка точно не известно. Есть гипотеза о том, что этот протеин заменяет некоторое подмножество субъед. E2 в коровьем PDH.
Связь с микроорганизмами
Рассматриваемый комплекс присущ некоторым видам бактерий анаэробного типа. Однако количество бактериальных организмов, имеющих в своем строении PDH, невелико. Функции, выполняемые комплексом у бактерий, как правило, сводятся к общим процессам. Например, роль пируватдегидрогеназного комплекса у бактерии Zymonomonas mobilis заключается в брожении спиртового характера. Пируват бактерии в размере до 98% израсходуется именно на подобные цели. Оставшиеся несколько процентов подвергаются окислению до углекислого газа, никотинамидадениндинуклеотида, ацетил-СоА и т. д. Интересно строение пируватдегидрогеназного комплекса у Зимомонас мобилис. У данного микроорганизма в него входит четыре фермента: E1альфа, Е1бета, Е2 и Е3. В PDH этой бактерии находится липоильный домен внутри Е1бета, что делает ее уникальной. Кор комплекса представляется Е2, а организация самого комплекса принимает вид додекаэдра пентагонального типа. Зимомонас мобилис не имеет целые ряды ферментов цикла трикарбоновых кислот, а потому ее PDH занимается только анаболическими функциями.
PDH в человеке
Человек, как и другие живые организмы, имеет гены, занимающиеся кодированием PDH. В Х-хромосоме локализируется ген E1альфа – PDHA 1. Механизм действия пируватдегидрогеназного комплекса чрезвычайно важен, что следует из того, что существует больше тридцати аллелей мутантного типа у вышеуказанного гена, и каждая из мутаций приводит к PDH-недостаточности. Симптоматика заболевания может сильно варьироваться от лактатацидозовых проблем слабовыраженного характера до летальных пороков в развитии организма. Мужчин, у которых Х-хромосома включает подобную аллель, ждет скорая гибель в совсем юном возрасте. Женские особи тоже подвергаются этому заболеванию, но в меньшей степени, а сама проблема заключается в инактивации какой-либо Х-хромосомы.
Проблематика мутаций
Е1бета – PDHB – располагается на третьей хромосоме. Известны лишь две аллели мутантного типа у данного гена, которые, находясь в гомозиготном положении, приводят к летальному исходу на протяжении года, что связанно с пороками развития.
Вероятно, есть и другие подобные аллели, которые могут вызвать смерть до полноценного развития организма. Е2 – DLAT – сосредоточен на одиннадцатой хромосоме. Человечеству известно о двух аллелях данного гена, которые создадут проблемы в будущем, однако правильная диета может это компенсировать. Существует большая вероятность того, что плод погибнет внутри утробы из-за других мутаций этого гена. E3 – dld – располагается на седьмой хромосоме и включает в себя большое количество аллелей. Довольно большой их процент приводит к возникновению болезней генетического характера, которые будут связаны с нарушением аминокислотного обмена.
Заключение
Мы рассмотрели, насколько важен для живых организмов пируватдегидрогеназный комплекс. Реакции, в нем происходящие, направлены, в первую очередь, на декарбоксилирование пирувата путем окисления, а сам PDH узкоспециализирован, но в разных условиях, при наличии определенных причин может выполнять и функции другого характера, например, участвовать в брожении. Также мы выяснили, что комплексы белкового типа, которые занимаются пируватным окислением, состоят из пяти ферментов, которые сохраняют работоспособность лишь при наличии пяти кофакторов. Любые изменения в алгоритме сложного механизма декарбоксилирования могут вызвать серьезные патологии и даже привести к смерти индивида.






























