Вещества, составляющие основу нашего физического мира, состоят из разных видов химических элементов. Четыре из них встречаются чаще всех остальных. Это водород, углерод, азот и кислород. Последний элемент может связываться с частицами металлов или неметаллов и образовывать бинарные соединения - окислы. В нашей статье мы изучим наиболее важные способы получения оксидов в лабораторных условиях и промышленности. Также рассмотрим их основные физические и химические свойства.
Агрегатное состояние
Оксиды, или окислы, существуют в трех состояниях: газообразном, жидком и твердом. Например, к первой группе относятся такие известные и широко распространенные в природе соединения, как углекислый газ - CO2, угарный газ - CO, двуокись серы - SO2 и другие. В жидкой фазе существуют такие окислы, как вода – H2O, серный ангидрид – SO3, оксид азота – N2O3. Получение оксидов, названных нами, можно осуществить в лаборатории, однако такие из них, как монооксид углерода и трехокись серы, добывают и в промышленности. Это связано с применением этих соединений в технологических циклах выплавки железа и получения сульфатной кислоты. Угарным газом восстанавливают железо из руды, а серный ангидрид растворяют в сульфатной кислоте и добывают олеум.
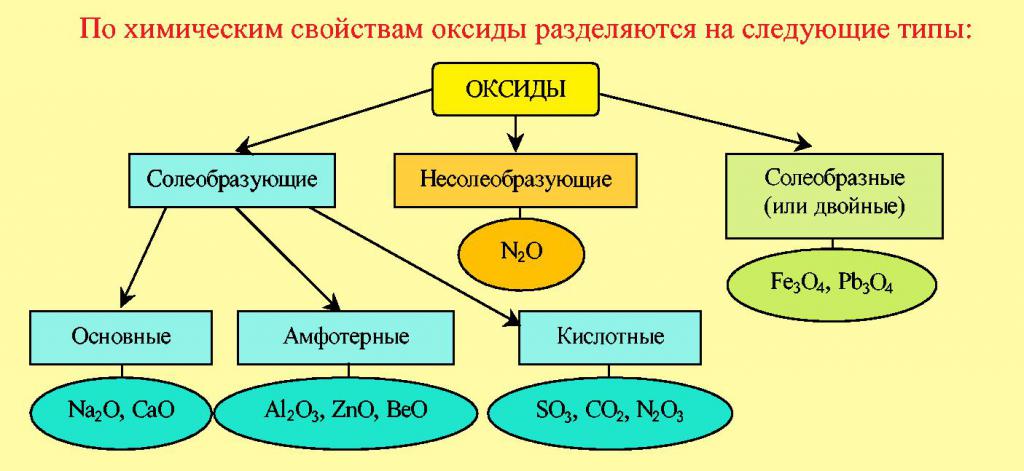
Классификация окислов
Можно выделить несколько видов кислородсодержащих веществ, состоящих из двух элементов. Химические свойства и способы получения оксидов будут зависеть от того, к какой из перечисленных групп относится вещество. Например, диоксид углерода, относящийся к кислотным окислам, получают прямым соединением углерода с кислородом, проводя реакцию жесткого окисления. Углекислый газ можно выделить и в процессе обмена солей угольной кислоты и сильных неорганических кислот:
HCl + Na2CO3 = 2NaCl + H2O + CO2
Какая же реакция является визитной карточкой кислотных оксидов? Это их взаимодействие со щелочами:
SO2 + 2NaOH → Na2SO3 + H2O

Амфотерные и несолеобразующие окислы
Безразличные окислы, например CO или N2O, не способны к реакциям, ведущим к появлению солей. С другой стороны, большинство кислотных оксидов могут вступать в реакцию с водой, образуя кислоты. Однако для оксида кремния это невозможно. Силикатную кислоту целесообразно получить косвенным путем: из силикатов, реагирующих с сильными кислотами. Амфотерными будут такие бинарные соединения с кислородом, которые способны к реакциям как со щелочами, так и с кислотами. В эту группу мы отнесем следующие соединения - это известные окислы алюминия и цинка.
Получение оксидов серы
В своих соединениях с кислородом сера проявляет различную валентность. Так, в сернистом газе, формула которого SO2, она четырехвалентна. В лаборатории диоксид серы получают в реакции между сульфатной кислотой и гидросульфитом натрия, уравнение которой имеет вид
NaHSO3 + H2SO4 → NaHSO4 + SO2 + H2O
Еще один способ добычи SO2 – это окислительно-восстановительный процесс между медью и сульфатной кислотой высокой концентрации. Третий лабораторный метод получения оксидов серы – сжигание под вытяжкой образца простого вещества серы:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O

В промышленности диоксид серы можно добыть выжиганием серосодержащих минералов цинка или свинца, а также обжигом пирита FeS2. Полученный таким методом сернистый газ используют для добычи трехокиси серы SO3 и далее – сульфатной кислоты. Двуокись серы с другими веществами ведет себя как окись с кислотными признаками. Например, ее взаимодействие с водой приводит к образованию сульфитной кислоты H2SO3:
SO2 + H2O = H2SO3
Данная реакция является обратимой. Степень диссоциации кислоты невелика, поэтому соединение относят к слабым электролитам, да и сама сернистая кислота может существовать только в водном растворе. В нем всегда присутствуют молекулы сернистого ангидрида, которые придают веществу резкий запах. Раагирующая смесь находится в состоянии равенства концентрации реагентов и продуктов, которое можно сместить, изменяя условия. Так, при добавлении к раствору щелочи реакция будет проходить слева направо. В случае выведения из сферы реакции сернистого ангидрида нагреванием или продуванием через смесь газообразного азота динамическое равновесие будет смещаться влево.
Серный ангидрид
Продолжим рассматривать свойства и способы получения оксидов серы. Если сжечь сернистый ангидрид, то в результате образуется оксид, в котором сера имеет степень окисления +6. Это трехокись серы. Соединение находится в жидкой фазе, быстро твердеет в виде кристаллов при температуре ниже 16 °С. Кристаллическое вещество может быть представлено несколькими аллотропными модификациями, отличающимися строением кристаллической решетки и температурами плавления. Серный ангидрид проявляет свойства восстановителя. Взаимодействуя с водой, он образует аэрозоль сульфатной кислоты, поэтому в промышленности H2SO4 добывают, растворяя серный ангидрид в концентрированной сульфатной кислоте. В результате образуется олеум. Добавляя в него воду, и получают раствор серной кислоты.
Основные окислы
Изучив свойства и получение оксидов серы, относящихся к группе кислотных бинарных соединений с кислородом, рассмотрим кислородные соединения металлических элементов.
Основные окислы можно определить по такому признаку, как наличие в составе молекул частиц металлов главных подгрупп первой или второй групп периодической системы. Они относятся к щелочным или щелочноземельным. Например, окись натрия - Na2O может реагировать с водой, в результате чего образуются химически агрессивные гидроксиды – щелочи. Однако главное химическое свойство основных оксидов – это взаимодействие с органическими или неорганическими кислотами. Оно идет с образованием соли и воды. Если к белому порошковидному оксиду меди добавить соляной кислоты, то обнаружим голубовато-зеленый раствор хлорида меди:
CuO + 2HCl = CuCl2 + H2O

Нагревание твердых нерастворимых гидроксидов - еще один важных способов получения основных оксидов:
Ca(OH)2 → CaO + H2O
Условия: 520-580 °C.
В нашей статье мы рассмотрели наиболее важные свойства бинарных соединений с кислородом, а также способы получения оксидов в лаборатории и промышленности.



























