Практически все элементы периодической системы Менделеева могут образовывать оксиды, или окислы – бинарные соединения, содержащие в своих молекулах атомы кислорода. Класс этих неорганических соединений, в свою очередь, делится на несколько групп: основные, кислотные, амфотерные и безразличные оксиды. Целью нашей статьи является изучение физических и химических свойств оксидов, а также их практического применения и значения для человека.
Способы получения
Главной химической реакцией получения окислов является непосредственное взаимодействие металла или неметалла с кислородом.
H2 + O2 = H2O (реакция идет с взрывом)
4K + O2 = 2K2O
К другим способам образования оксидов можно отнести горение сложных веществ, например, углеводородов. Оно заканчивается получением углекислого газа и воды. При термическом разложении нерастворимых в воде оснований или солей: карбонатов, нитратов также выделяются оксиды. Примеры таких реакций приведены ниже:
- Fe(OH)2=FeO+H2O оксид железа (II)
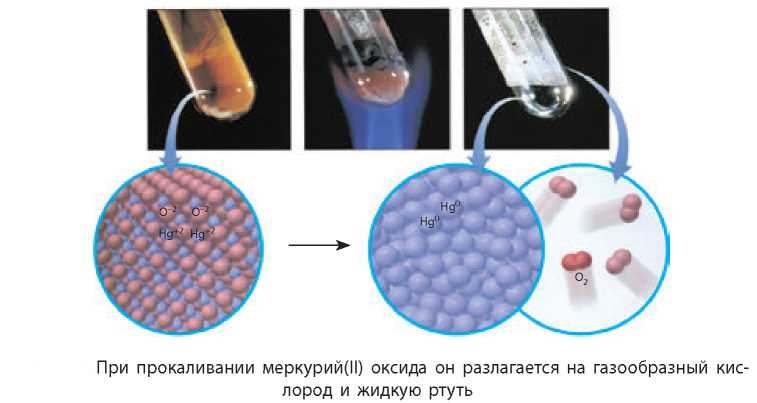
- 2KNO3= 2KNO2 + O2↑
Физическая характеристика
Агрегатное состояние бинарных соединений кислорода с металлами или неметаллами может быть различным. Например, оксиды углерода, двуокись азота, окись серы (IV) – газы. Жидкостями являются вода, серный ангидрид, а оксиды металлов – это твердые вещества. Растворимость соединений также различна. Приведем примеры оксидов с различной степенью взаимодействия с водой. Так, углекислый газ растворяется в воде при комнатной температуре в соотношении 1:1, оксид азота (II) - малорастворимый, а диоксид кремния нерастворим вовсе.
Основные оксиды
Если в состав молекулы вещества входят атомы типичных металлов, оно проявляет основные свойства. Вещество будет реагировать с кислотами и кислотными оксидами, а также с водой. Например, оксид кальция может реагировать с хлоридной кислотой:
2HCl + CaO = CaCl2 + H2O.
Продуктами реакции будет средняя соль и вода. Если этот же оксид кальция вступает во взаимодействие с оксидом углерода, то получаем одно вещество – соль.
CaO + CO2 = CaCO3.
Свойства оксидов, образованных металлами, нашли применение в различных отраслях промышленности. Так, оксид кальция, называемый еще негашеной или жженой известью, имеет важное значение как сырье для получения гашеной извести. Гидроксид кальция широко используется в промышленности в качестве строительного раствора. Известковую воду применяют в качестве индикатора на присутствие в растворе молекул углекислого газа.

Примеры оксидов, входящих в состав железной руды – это FeO и Fe2O3 – бурый и магнитный железняк. В домне их восстанавливают коксом и оксидами углерода и получают сплав железа с углеродом – чугун. В процессе его дальнейшей переработки в металлургической промышленности выплавляют различные сорта стали, в том числе и легированной.
Реакция с водой оксидов щелочных или щелочноземельных металлов приводит к получению щелочи.
Характеристика кислотных окислов
Оксиды азота, карбона, серы, кремния и др. образуют группу кислотных окислов. Химические свойства оксидов – это реакции со щелочами, основными окислами и водой. Продуктами взаимодействия между гидроксидом калия и углекислым газом будут карбонат калия и вода. Если между собой вступают в реакцию основание натрия и диоксид кремния, получаем силикат натрия и воду.
Некоторые кислотные оксиды реагируют с водой. Продуктом реакции будет соответствующая кислота (угольная):
CO2 + H2O = H2CO3.

Кислотные оксиды, примеры которых мы приведем далее, имеют важное значение. Так, серный ангидрид SO3 – бесцветная жидкость, является исходным сырьем для промышленного получения сульфатной кислоты – основного продукта химической промышленности. Соединения азота, например, NO2, используют для производства нитратной кислоты. В реакции кроме диоксида азота, участвуют также вода и кислород. Азотная кислота, полученная в результате реакции оксидов азота с водой, применяется в производстве минеральных удобрений, взрывчатых веществ, красителей, лекарственных препаратов, пластмасс и т.д
Амфотерные соединения
Окислы, в состав которых входят, например, атомы цинка или алюминия, проявляют двойственные химические свойства. Они могут реагировать как с кислотами, так и с щелочами. В этом случае продуктами взаимодействия оказываются средние соли. Вот характеристика физических свойств некоторых амфотерных оксидов, примеры которых мы рассмотрим. Так, Al2O3 - это корунд, он представляет собой твердое вещество, температура плавления которого достигает 2050°. В природе окисел входит в состав глинозема, а также образует окрашенные кристаллы, являющиеся драгоценными камнями - рубины и сапфиры.
Оксид цинка ZnO – это бесцветные кристаллы, при температуре 1800° переходящие в состояние пара. Это явление называется сублимацией. Вещество нерастворимо в воде, при вдыхании пылевидных частиц вызывает отравление. Окись цинка нашла применение в качестве абразивного материала, в производстве красок, искусственной кожи, в медицине, в стоматологии - в качестве пломбировочного материала.

В нашей статье мы изучили классификацию оксидов, химические и физические их свойства, а также применение в промышленности.



























