Многие задачи в химии связаны с вычислением молярной массы вещества, с которым проводятся опыты. В статье рассмотрим один из примеров таких задач и найдем, чему равна молярная масса сульфата бария. Также рассмотрим, в каких областях человеческой деятельности используется это вещество.
Что такое сульфат бария?

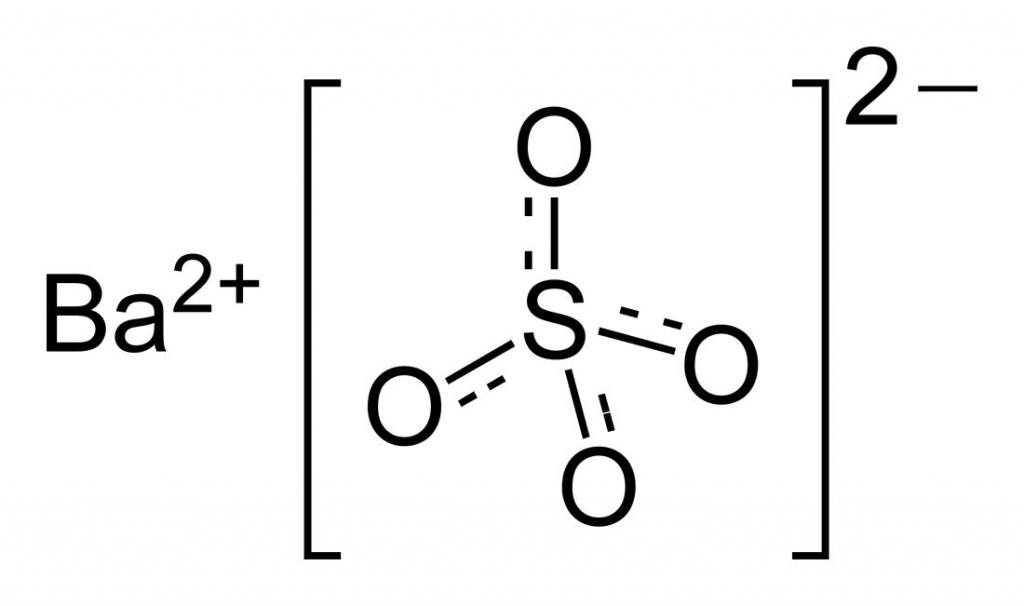
Прежде чем рассматривать вопрос молярной массы сульфата бария, познакомимся поближе с этим веществом. Оно, с химической точки зрения, представляет собой соль, образованную сульфат-анионом и катионом бария. Его формулу можно записать следующим образом: BaSO4.
Сульфат бария является белым порошком, который обладает высокой химической инертностью. Так, он не только не растворяется в воде, но и не реагирует со многими щелочами и кислотами. Растворяется он только в концентрированной серной кислоте, а также восстанавливается до оксида бария при нагреве выше 1600 oC.
В природе сульфат бария встречается во многих рудах этого металла, например, он является основным веществом минерала барит.
Благодаря своему белому цвету и химической инертности, эта соль применяется в качестве специальной "каши", которую употребляет в пищу пациент во время рентгеновского исследования желудка (тяжелые атомы бария хорошо поглощают рентгеновские лучи), а также используется при производстве белых красителей в пластмассах.
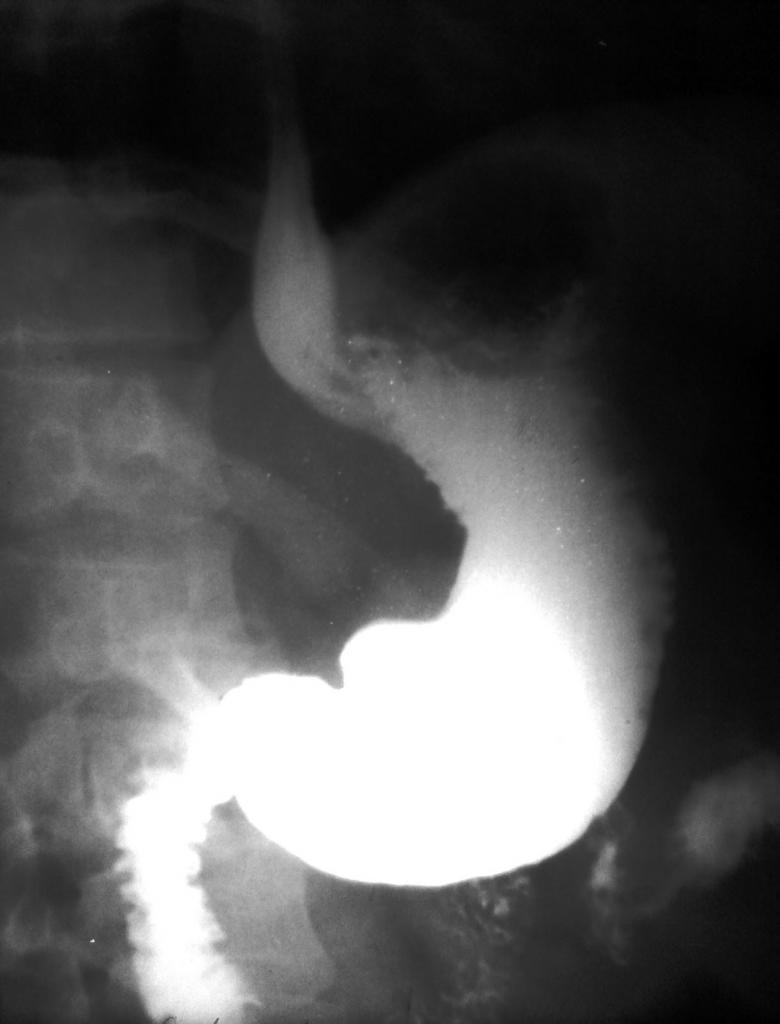
Любопытно отметить, что почти все соли бария являются ядовитыми и при попадании в организм вызывают сильные отравления. Сульфат бария в этом плане безвреден благодаря его нерастворимости в кислой среде нашего желудка.
Понятие о молярной массе
Прежде чем ответить на вопрос о том, что такое молярная масса сульфата бария, необходимо разобраться с этим понятием. Молярная масса представляет собой отношение массы вещества к количеству молей этого вещества, то есть массу одного моля вещества
Слово "моль" является одной из семи основных или базовых единиц измерения в системе СИ, которая была добавлена в нее в 1971 году. Эта величина означает количество элементов, которое составляет рассматриваемый материал. Это могут быть атомы, молекулы, ионы, электроны, в общем случае любые частицы, на которые можно разделить объект. Значение 1 моль принято считать равным числу Авогадро (NA = 6.022 * 1023). Откуда взялось это число? Все просто, оно точно соответствует числу атомов в 2 граммах газообразного водорода (H2), то есть 1 грамм атомарного водорода (H) так же будет содержать 1 моль частиц.
Использование этой единицы в физике и химии является удобным, ввиду малых размеров атомов и молекул и их большого количества.
Как рассчитать молярную массу сульфата бария?
Теперь, когда разобрано понятие молярной массы, можно переходить непосредственно к теме статьи. Как можно понять из предыдущего пункта, чтобы рассчитать массу 1 моль рассматриваемой соли, необходимо знать, сколько весит одна ее молекула, то есть BaSO4.
Согласно химической формуле, рассматриваемая молекула состоит из одного атома бария, одного атома серы и четырех атомов кислорода. Идея расчета ее массы заключается в суммировании атомных масс соответствующих элементов. Необходимые данные можно найти в периодической системе Д. И. Менделеева.
Использование таблицы Менделеева: атомные молярные массы
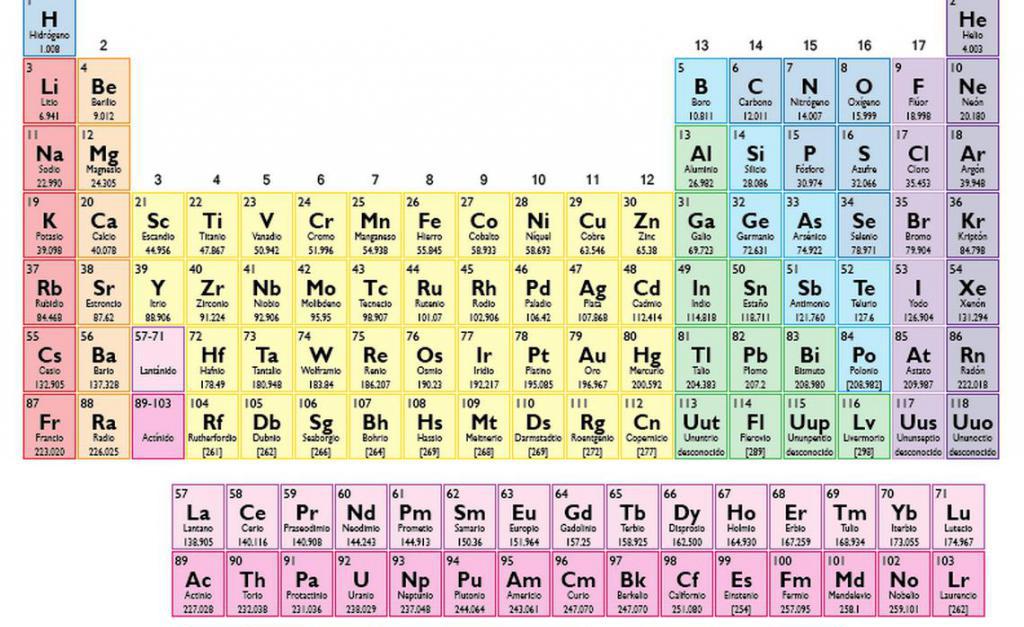
Если обратиться к периодической системе химических элементов, то можно увидеть, что в каждой клетке, представляющей химический элемент, приводится информация о заряде ядра его атома (порядковый номер), конфигурация внешних электронных оболочек, а также некоторое число, которое отражает молярную массу атомов соответствующего элемента.
Из таблицы получаем необходимые молярные массы:
- M(Ba): 137,327;
- M(S): 32,065;
- M(O): 15,999.
Все приведенные значения имеют размерность грамм на моль (г/моль). Отметим, что эти цифры являются усредненным значением между массами разных изотопов одного химического элемента, ядра атомов которого содержат постоянное количество протонов, но число нейтронов может изменяться. Так, барий в действительности является смесью из 6 изотопов, которые могут считаться относительно стабильными, поскольку имеют большие значения периодов полураспада.
Полученные из таблицы Менделеева значения для отдельных атомов можно использовать, чтобы определить, чему равна молярная масса сульфата бария.
Молярная масса BaSO4
Чтобы рассчитать молярную массу сульфата бария 2 (цифра указывает валентность, которую проявляет атом металла в химическом соединении), необходимо сложить соответствующие величины для каждого элемента, учитывая их количество в рассматриваемой молекуле соли. Так, соединение BaSO4 образовано 6-тью атомами: по одному атому Ba и S и 4 атома O. Молярная масса соединения равна: M(BaSO4) = 1 * M(Ba) + 1 * M(S) + 4 * M(O) = 1 * 137,327 + 1 * 32,065 + 4 * 15,999 = 233,388 г/моль.
Справедливости ради следует отметить, что образование устойчивых химических соединений из отдельных атомов сопровождается выделением некоторого количества энергии. Согласно же уравнению Эйнштейна (E = m*c2), потеря энергии эквивалентна потери массы. Поэтому в действительности молярная масса соединения BaSO4 будет иметь меньшее значение, чем посчитанная величина, однако, эта поправка настолько незначительна, что ей пренебрегают.
Рассмотренный на примере сульфата бария способ расчета молярной массы можно применять абсолютно к любым соединениям. Для этого лишь важно знать их химические формулы.



























