Каждый школьник, который внимательно изучал таблицу Менделеева, наверняка заметил, что, помимо номера химического элемента, в ней присутствует информация о весе его атома. В данной статье рассмотрим, что такое молярная масса и где она используется.
Что такое моль?
Прежде чем ответить на вопрос "что такое молярная масса", необходимо разобраться с такой важной величиной в химии, как моль.
В XIX веке Амедео Авогадро, внимательно изучая закон Гей-Люссака для идеальных газов при изохорном процессе, пришел к умозаключению, что в одинаковых объемах разных веществ при идентичных условиях (температура и давление) содержится равное число атомов или молекул. Идеи Авогадро противоречили теориям того времени о химическом строении и поведении газовых субстанций, поэтому они были приняты только спустя полвека.
В начале XX века с помощью более современных технологий удалось определить количество молекул водорода в 2 граммах этого газа. Это количество получило название "моль". Сам термин был введен Вильгельмом Оствальдом, с латыни он переводится как "куча", "скопление".
В 1971 году моль стал одной из 7 основных единиц измерения в системе СИ. В настоящее время под 1 молем понимают такое количество атомов кремния, которое содержится в идеальной сфере массой 0,028085 кг. Само число частиц, соответствующее 1 моль, называется числом Авогадро. Равно оно приблизительно 6,02*1023.
Что такое молярная масса?
Теперь можно вернуться к теме статьи. Моль и молярная масса - это две взаимосвязанные величины. Под второй понимают вес одного моль любого вещества. Очевидно, что тип химического элемента или состав молекулы того или иного газа напрямую определяет молярную массу. Согласно данному определению, можно записать следующее выражение:
M = ma * NA.
Где ma - это масса одного атома, NA - число Авогадро. То есть для получения величины M необходимо умножить вес одной частицы (молекулы, атома, атомного кластера) на число Авогадро.
Как было отмечено во введении статьи, каждый элемент в периодической таблице содержит информацию о его атомной массе. Она представляет собой вес в граммах на моль. Очевидно, чтобы получить молярную массу в кг/моль, следует табличное значение разделить на 1000. Например, для ниобия под номером 41 мы видим цифру 92,9, то есть 1 моль его атомов имеет вес 92,9 грамма.
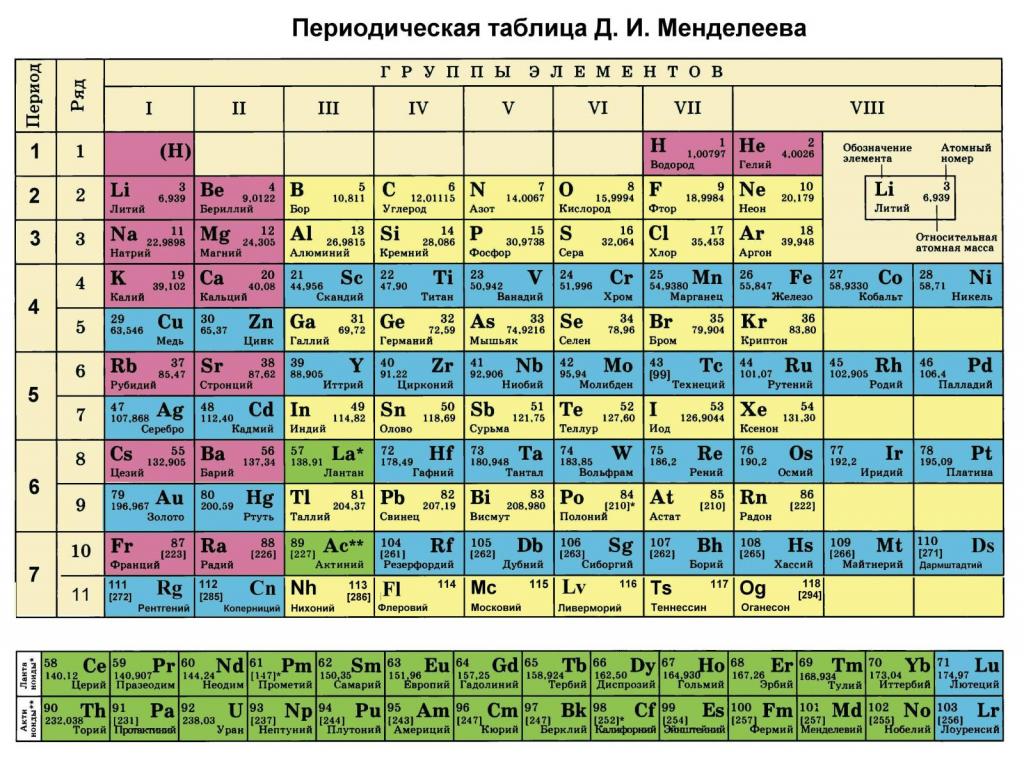
Где используется величина M в химии?
Зная теперь, что такое молярная масса, рассмотрим, где ее применяют в химии.
Понятие количества вещества и молярного веса играет важную роль при составлении химических реакций, поскольку они идут только при строгом соотношении реагентов. Для примера ниже приведена реакция сгорания водорода с образованием молекулы воды:
2H2 + O2 = 2H2O.
Видно, что 2 моль водорода, которые имеют массу 4 грамма, реагируют без остатка с 1 моль кислорода весом 32 грамма. В результате образуется 2 моль молекул воды, с показателем в 36 граммов. Из этих цифр ясно, что в процессе химических превращений масса сохраняется. В действительности же вес реагентов и продуктов превращения немного отличается. Эта небольшая разница связана с тепловым эффектом реакции. Разницу в массах можно рассчитать, если использовать формулу Эйнштейна для связи веса и энергии.
В химии понятие молярной массы также тесно связано с одноименной концентрацией. Обычно твердые вещества, которые растворимы в жидкостях, характеризуют количеством молей в одном литре, то есть молярной концентрацией.
Важно понимать, что рассматриваемая величина является постоянной только для данного химического элемента или конкретного соединения, например, для H2 она равна 2 г/моль, а для O3 - 48 г/моль. Если ее значение для одного соединения больше, чем для другого, то это означает, что сама элементарная частица первого вещества имеет большую массу, чем второго.
Газы и их молярный объем
Молярная масса также связана с физикой идеальных газов. В частности, ей пользуются во время определения объема газовой системы при конкретных внешних условиях, если известно количество вещества.

Идеальные газы описываются уравнением Клапейрона-Менделеева, которое имеет вид:
P * V = n * R * T.
Здесь n - это количество вещества, которое с молярной массой связано так:
n = m / M.
Объем газа можно определить, если известны его m, температура T и давление P, по следующей формуле:
V = m * R * T / (M * P).
Молярным объемом называется такой, который при 0 oC и давлении в одну атмосферу занимает 1 моль любого газа. Из формулы выше можно рассчитать эту величину, она составляет 22,4 литра.



























