При взгляде на кристаллы и изделия из самоцветов хочется понять, как могла появиться эта загадочная красота, каким образом создаются такие удивительные произведения природы. Появляется желание больше узнать об их свойствах. Ведь особенное, нигде в природе не повторяющееся строение кристаллов позволяет использовать их повсеместно: от ювелирных украшений до новейших научных и технических изобретений.
Изучение кристаллических минералов
Строение и свойства кристаллов столь многогранны, что изучением и исследованием этих явлений занимается отдельная наука – минералогия. Знаменитый российский академик Александр Евгеньевич Ферсман настолько был поглощен и удивлен разнообразием и безграничностью мира кристаллов, что стремился увлечь как можно больше умов этой темой. В своей книге «Занимательная минералогия» он с энтузиазмом и теплотой призывал познакомиться с тайнами минералов и окунуться в мир самоцветов:
Я очень хочу вас увлечь. Хочу, чтобы вы начали интересоваться горами и каменоломнями, рудниками и копями, чтобы вы начали собирать коллекции минералов, чтобы вы захотели отправиться вместе с нами из города подальше, к течению реки, где высокие каменистые берега, к вершинам гор или к скалистому берегу моря, туда, где ломают камень, добывают песок или взрывают руду. Там всюду мы с вами найдем, чем заняться: и в мертвых скалах, песках и камнях мы с вами научимся читать какие-то великие законы природы, которые управляют всем миром и по которым построен весь мир.
Изучением кристаллов занимается физика, утверждая, что всякое действительно твердое тело является кристаллом. Химия исследует молекулярное строение кристаллов, приходя к выводу, что любой металл имеет кристаллическое строение.
Изучение удивительных свойств кристаллов имеет огромное значение для развития современных науки, техники, строительной промышленности и многих других отраслей.

Основные законы кристаллов
Первое, на что обращают внимание при взгляде на кристалл – это идеальная многогранная форма, но не она является главной особенностью минерала или металла.
При разбивании кристалла на маленькие осколки от идеальной формы ничего не останется, но при этом любой осколок, как и прежде, будет оставаться кристаллом. Отличительной чертой кристалла является не его внешний вид, а характерные черты его внутреннего строения.
Симметричность
Первое, что стоит вспомнить и отметить при изучении кристаллов - это явление симметрии. Оно широко распространено в окружающей повседневной жизни. Симметричны крылья бабочки, отпечаток кляксы на листе бумаги, согнутом пополам. Симметричны снежные кристаллы. Шестиугольная снежинка имеет шесть плоскостей симметрии. Сгибая рисунок по любой линии, изображающей плоскость симметрии снежинки, можно совместить друг с другом две ее половины.
Ось симметрии обладает таким свойством, что, поворачивая фигуру на некоторый известный угол вокруг нее, можно совместить между собой подходящие части фигуры. В зависимости от размера подходящего угла, на который нужно повернуть фигуру, в кристаллах определяют оси 2-го, 3-го, 4-го и 6-го порядка. Таким образом, в снежинках наблюдается единственная ось симметрии шестого порядка, которая является перпендикулярной к чертежной плоскости.
Центром симметрии считается такая точка в плоскости фигуры, на одинаковом расстоянии от которой в противоположном направлении находятся одинаковые элементы строения фигуры.

А что внутри?
Внутреннее строение кристаллов – это своеобразное соединение молекул и атомов в свойственном только кристаллам порядке. Каким образом узнают внутреннее строение частиц, если они не видимы даже в микроскоп?
Для этого используются рентгеновские лучи. Применяя их для просвечивания кристаллов, немецкий физик М. Лауэ, английские физики отец и сын Брэгг, российский профессор Ю. Вульф установили законы, согласно которым изучается структура и строение кристаллов.
Все оказалось удивительно и неожиданно. Само представление о строении молекулы оказалось неприменимым к кристаллическому состоянию вещества.
Например, такое известное всем вещество, как поваренная соль, имеет химический состав молекулы NaCl. Но в кристалле отдельные атомы хлора и натрия не складываются в отдельные молекулы, а образуют определенную конфигурацию, называемую пространственной или кристаллической решеткой. Мельчайшие частицы хлора и натрия имеют электрическую связь. Кристаллическая решетка соли складывается следующим образом. Один из валентных электронов внешней оболочки атома натрия внедряется во внешнюю оболочку атома хлора, которая не полностью заполнена из-за отсутствия в третьей оболочке хлора восьмого электрона. Таким образом, в кристалле каждый ион как натрия, так и хлора принадлежат не одной молекуле, а всему кристаллу. Из-за того, что атом хлора одновалентен, он может присоединить к себе только один электрон. Но особенности строения кристаллов приводят к тому, что атом хлора окружен шестью атомами натрия, и невозможно определить, какой из них поделится с хлором электроном.
Получается, что химическая молекула поваренной соли и ее кристалл – совсем не одно и то же. Весь монокристалл – это как бы одна гигантская молекула.
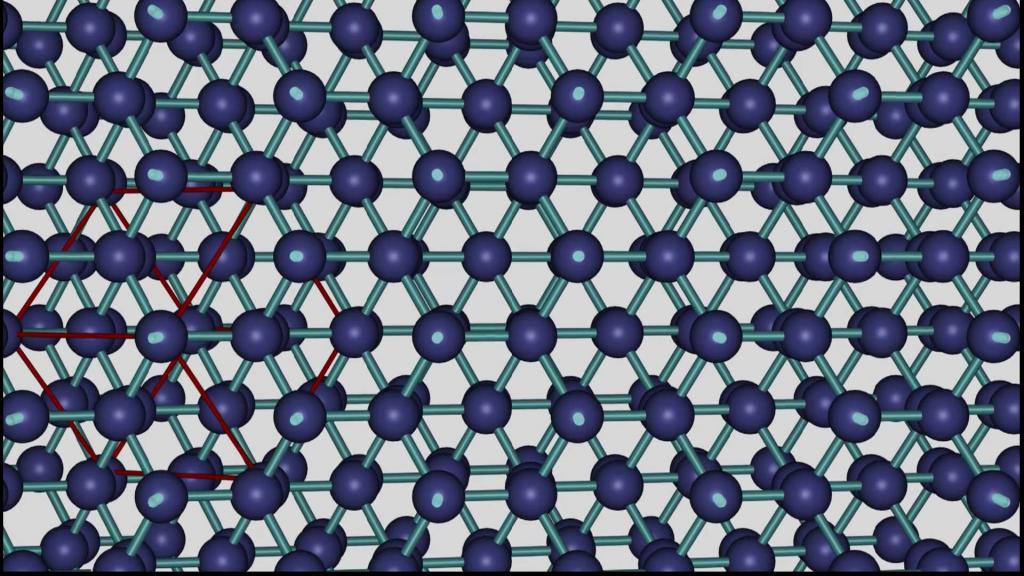
Решетка – только модель
Следует избегать ошибки, когда пространственную решетку принимают за действительную модель кристаллического строения. Решетка – своеобразное условное изображение примера соединения элементарных частиц в строении кристаллов. Места соединения решетки в виде шариков наглядно позволяют изобразить атомы, а линии, их соединяющие – это примерное изображение связующих сил между ними.
В реальности промежутки между атомами внутри кристалла гораздо меньше. Он является плотной упаковкой составляющих его частиц. Шарик – условное обозначение атома, использование которого позволяет удачно отразить свойства плотной упаковки. В реальности имеет место не простое соприкосновение атомов, а взаимное их частичное перекрывание друг другом. Иными словами, изображение шара в строении кристаллической решетки – это для наглядности изображенная сфера такого радиуса, которая вмещает основную часть электронов атома.
Залог прочности
Между двумя противоположно заряженными ионами возникает электрическая сила притяжения. Она является связующей в строении ионных кристаллов, таких как поваренная соль. Но если сильно приблизить ионы, то их электронные орбиты станут перекрывать друг друга, появятся отталкивающие силы одноименно заряженных частиц. Внутри кристалла распределение ионов таково, что отталкивающие и притягивающие силы находятся в равновесии, обеспечивая кристаллическую прочность. Такое строение характерно для ионных кристаллов.
А в кристаллических решетках алмаза и графита имеет место соединение атомов с помощью общих (коллективных) электронов. У близко расположенных атомов имеются общие электроны, которые вращаются вокруг ядра как одного, так и соседнего атомов.
Детальное изучение теории сил при таких связях довольно сложно и лежит в области квантовой механики.

Отличия металлов
Строение кристаллов металлов более сложно. В связи с тем, что атомы металла легко отдают имеющиеся внешние электроны, они могут свободно перемещаться по всему объему кристалла, образуя внутри него так называемый электронный газ. Благодаря таким «блуждающим» электронам создаются силы, обеспечивающие прочность металлического слитка. Изучение строения реальных кристаллов металла показывает, что в зависимости от способа охлаждения металлического слитка в нем могут иметься несовершенства: поверхностные, точечные и линейные. Размеры таких дефектов не превышают диаметр нескольких атомов, но они искажают кристаллическую решетку и влияют на диффузионные процессы в металлах.
Рост кристалла
Для более удобного понимания рост кристаллического вещества можно представить как возведение кирпичного строения. Если один кирпич незаконченной кладки представить как составную часть кристалла, то можно определить, куда будет расти кристалл. Свойства энергетики кристалла таковы, что положенный на первый кирпич будет испытывать притяжение с одной стороны - снизу. При укладке на второй – с двух сторон, а на третий – с трех. В процессе кристаллизации – переходе из жидкого состояния в твердое – происходит выделение энергии (теплоты плавления). Для наибольшей прочности системы ее возможная энергия должна стремиться к минимальной. Поэтому рост кристаллов происходит слой за слоем. Сначала будет достроен ряд плоскости, затем вся плоскость, и только тогда начинает строиться следующая.
Наука о кристаллах
Основной закон кристаллографии – науки о кристаллах – говорит о том, что все углы между различными плоскостями кристаллических граней всегда постоянны и одинаковы. Как бы ни искажался растущий кристалл, углы между его гранями сохраняют одно и то же значение, присущее данному виду. Независимо от размера, формы и числа, грани одной плоскости кристалла всегда пересекаются под одинаковым предопределенным углом. Закон постоянства углов был открыт М.В. Ломоносовым в 1669 году и сыграл большую роль в изучении строения кристаллов.
Анизотропия
Своеобразие процесса формирования кристаллов обусловлено явлением анизотропии – различающимися физическими характеристиками в зависимости от направления роста. Монокристаллы в разных направлениях по-разному проводят электричество, тепло и свет и имеют неодинаковую прочность.
Таким образом, один и тот же химический элемент с одинаковыми атомами может образовывать различные кристаллические решетки. Например, углерод может кристаллизоваться в алмаз и в графит. При этом алмаз является примером максимальной прочности среди минералов, а графит легко оставляет свои чешуйки при письме карандашом на бумаге.
Измерение углов между гранями минералов имеет большое практическое значение для определения их природы.

Основные свойства
Узнав особенности строения кристаллов, кратко можно описать их основные свойства:
- Анизотропность – неодинаковость свойств в разных направлениях.
- Однородность – элементарные составляющие кристаллов, одинаково расположенные в пространстве, имеют одинаковые свойства.
- Способность к самоогранке – любой обломок кристалла в подходящей для его роста среде примет многогранную форму и покроется соответствующими данному виду кристаллов гранями. Именно это свойство позволяет кристаллу сохранять свою симметричность.
- Неизменность температуры плавления. Разрушение пространственной решетки минерала, то есть переход кристаллического вещества из твердого состояния в жидкое, всегда происходит при одной и той же температуре.

Кристаллы – твердые вещества, принявшие естественную форму симметричного многогранника. Строение кристаллов, характеризующееся формированием пространственной решетки, послужило основой для развития в физике теории электронной структуры твердого тела. Изучение свойств и строения минералов имеет важное практическое значение.


























