Химические реакции - это процессы преобразования веществ. Однако среди их многообразия особняком стоит группа окислительно-восстановительных реакций (ОВР). Давайте разберемся, в чем их особенность.
Сущность окислительно-восстановительных реакций
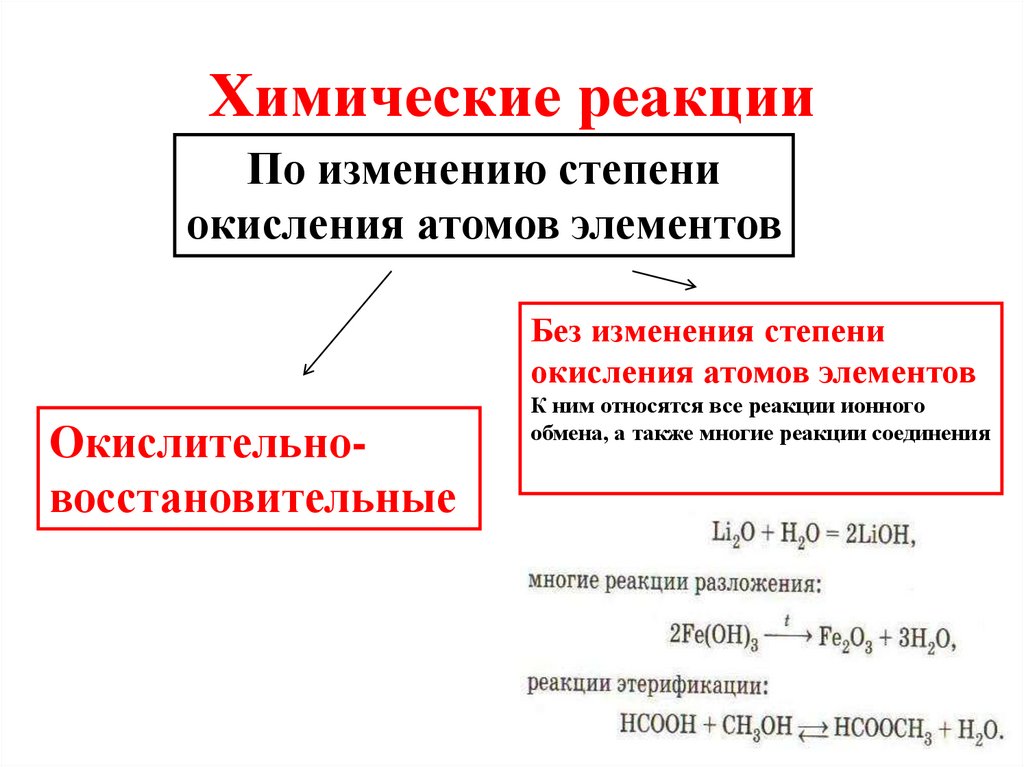
Окислительно-восстановительные реакции - это реакции, в которых происходит обмен электронами между атомами, молекулами или ионами. Этот обмен приводит к изменению степеней окисления химических элементов.
Любая ОВР включает два ключевых участника:
- Окислитель - вещество, которое отдает электроны, окисляется;
- Восстановитель - вещество, которое принимает электроны, восстанавливается.
Соответственно, можно выделить две протекающие одновременно полуреакции:
- Окисление - отдача электронов и повышение степени окисления;
- Восстановление - принятие электронов и понижение степени окисления.
Различают несколько типов ОВР:
- Межмолекулярные - обмен электронами между разными молекулами или ионами;
- Внутримолекулярные - обмен внутри одной молекулы;
- Диспропорционирование (самоокисление-самовосстановление);
- Конпропорционирование (выравнивание степеней окисления).

Классификация ОВР по составу реагентов
Помимо изменения степеней окисления, окислительно-восстановительные реакции можно классифицировать по составу исходных реагентов и продуктов реакции. В этом плане выделяют несколько типов:
- Реакции соединения - образование сложных молекул из более простых, например:
2Mg + O2 = 2MgO - Реакции разложения - распад сложных молекул на более простые, например:
2H2O = 2H2 + O2 - Реакции замещения - замена одних атомов или групп атомов в молекуле на другие, например:
CaO + SiO2 = CaSiO3 - Реакции обмена - обмен атомами или группами между молекулами без изменения степеней окисления, например:
NaCl + AgNO3 = NaNO3 + AgCl
Для каждого типа реакций можно привести множество конкретных примеров окислительно-восстановительных реакций из неорганической и органической химии. Однако в рамках этой статьи мы не будем на них подробно останавливаться.
к окислительно восстановительным реакциям относится изменение степеней окисления химических элементов при обмене электронами.
Важно понимать, что помимо перераспределения электронов, ОВР также сопровождаются обменом атомами и группами атомов между молекулами исходных веществ и продуктов реакции. Этот обмен может протекать в виде соединения, разложения, замещения и других типов реакций. Поэтому классификация ОВР по составу участников не менее важна, чем по изменению степеней окисления.
Тепловой эффект ОВР
Помимо изменения состава и степеней окисления веществ, окислительно-восстановительные реакции характеризуются тепловым эффектом. По этому признаку ОВР делятся на экзо- и эндотермические.
- Экзотермические - с выделением теплоты, Q > 0;
- Эндотермические - с поглощением теплоты, Q < 0.
Тепловой эффект напрямую связан с изменением энтальпии ΔH системы. Для экзотермических ОВР ΔH < 0, для эндотермических ΔH > 0. Также от теплового эффекта зависит возможность протекания реакции:
- Экзотермические реакции обычно протекают самопроизвольно;
- Эндотермические требуют затрат энергии на разрыв и образование связей.
Благодаря тепловым эффектам окислительно-восстановительные реакции нашли широкое применение в промышленности и быту - от получения металлов до горения топлива.
Механизмы протекания ОВР
Хотя общие черты окислительно-восстановительных реакций известны, механизмы их протекания могут существенно различаться для газообразной, жидкой и твердой сред. Рассмотрим особенности ОВР в некоторых наиболее распространенных средах.
ОВР в водных растворах
В водных растворах окислительно-восстановительные реакции часто сопровождаются гидролизом, диссоциацией и другими процессами. Это приводит к образованию различных ионов, участвующих в последующих превращениях. Поэтому механизм ОВР в растворах гораздо сложнее, чем в газообразной среде.
ОВР в неорганических соединениях
Твердые неорганические соединения могут также вступать в окислительно-восстановительные реакции. Однако для этого обычно требуются высокие температуры, достигаемые при плавлении или разложении веществ. Кроме того, скорость ОВР в конденсированной фазе значительно ниже, чем в газообразной или жидкой.
Методы составления уравнений ОВР
Для того чтобы рассчитать количественные соотношения продуктов окислительно-восстановительной реакции, необходимо составить ее уравнение. Существует два основных метода:
- Метод полуреакций - для реакций в растворах;
- Метод электронного баланса - для реакций в газовой фазе.
Рассмотрим их подробнее.
Метод полуреакций
Этот метод предполагает запись уравнений окисления и восстановления отдельно друг от друга с учетом всех превращений веществ:
- Запись полуреакций окисления и восстановления;
- Подбор коэффициентов для уравнивания электронов;
- Сложение полуреакций;
- Подбор коэффициентов для уравнивания элементов.
Рассмотрим на конкретном примере взаимодействия HCl c KMnO 4 в кислой среде:
1) Полуреакции:
Окисление: Mn+7 + 5e → Mn+2
Восстановление: 2H+ + 2e → H2
2) Уравнивание электронов: 5e (окисление) = 2e (восстановление) Вводим коэффициент 2 перед уравнением восстановления
3) Суммируем полуреакции: 2Mn+7 + 5e → 2Mn+2 4H+ + 4e → 2H2
4) Уравниваем элементы с помощью коэффициентов: 2Mn+7 + 5e + 8H+ → 2Mn+2 + 4H2O
Окончательное уравнение: 2KMnO 4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Таким образом, к окислительно восстановительным реакциям относится поэтапное составление уравнений с учетом промежуточных превращений реагентов.
Ключевые особенности ОВР
Подводя итог, отметим к окислительно восстановительным реакциям относится ряд ключевых особенностей:
- Изменение степеней окисления при обмене электронами;
- Наличие окислителя и восстановителя;
- Возможная многостадийность процесса;
- Тепловые эффекты;
- Классификация по составу реагентов;
- Различные механизмы протекания.
Эти особенности позволяют выделить окислительно-восстановительные реакции в отдельный класс среди других химических превращений. Их изучение имеет большое теоретическое и практическое значение в различных областях естествознания и техники.
























