Спирты – это отдельный класс органических соединений, которые в своем составе содержат одну или несколько гидроксильных группу. В зависимости от количества групп ОН эти кислородсодержащие соединения делятся на одноатомные спирты, трехатомные и т.д. Чаще всего эти сложные вещества рассматривают как производные углеводородов, молекулы которых претерпели изменения, т.к. один или несколько атомов водорода заместились на гидроксильную группу.

Наиболее простыми представителями данного класса являются одноатомные спирты, общая формула которых выглядит так: R-OH или
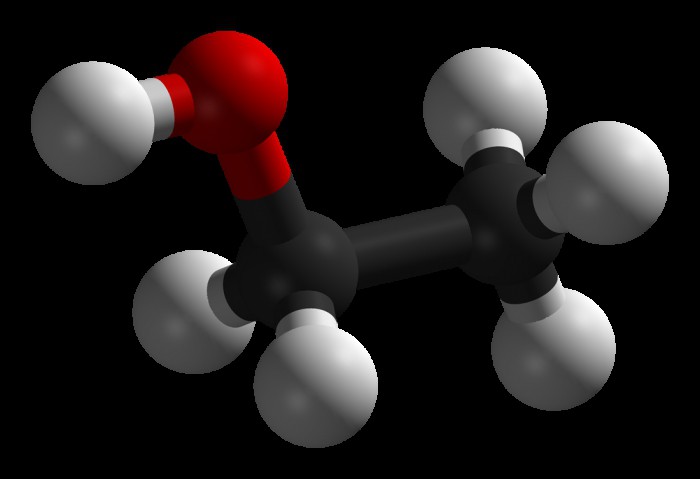
Гомологический ряд этих соединений начинается метиловым спиртом или метанолом (СН3ОН), вслед за которым идет этанол (С2Н5ОН), затем пропанол (С3Н7ОН) и т.д.
Для алкоголей характерна изомерия карбонового скелета и функциональной группы.
Одноатомные спирты проявляют такие физические свойства:
- Спирты, содержащие до 15 атомов углерода – жидкости, 15 и более – твердые вещества.
- Растворимость в воде зависит от молекулярной массы, чем она выше, тем спирт хуже растворяется воде. Так, низшие спирты (до пропанола) смешиваются с водой в любых пропорциях, а высшие практически не растворимы в ней.
- Температура кипения также возрастает с увеличением атомной массы, например, t кип. СН3ОН= 65 °С, а t кип. С2Н5ОН =78 °С.
- Чем выше температура кипения, тем ниже летучесть, т.е. вещество плохо испаряется.
Данные физические свойства насыщенных спиртов с одной гидроксильной группой можно объяснить возникновением межмолекулярной водородной связи между отдельными молекулами самого соединения или спирта и воды.
Одноатомные спирты способны вступать в такие химические реакции:
- Горение - пламя светлое, выделяется тепло: С2Н5ОН + 3О2 – 2СО2+2Н2О.

- Замещение – взаимодействие алканолов с активными металлами, продуктами реакции являются нестойкие соединения - алкоголяты, - способные разлагаться водой: 2С2Н5ОН+ 2К – 2С2Н5ОК +Н2.
- Взаимодействие с галогеноводородными кислотами: С2Н5ОН + HBr - С2Н5Br+Н2О.
- Эстерификация с органическими и неорганическими кислотами, в результате которой образуется эфир.
- Окисление, при котором получаются альдегиды или кетоны.
- Дегидратация. Данная реакция происходит при нагревании с помощью катализатора. Внутримолекулярная дегидратация у низших спиртов происходит по правилу Зайцева, итогом данной реакции является образование воды и ненасыщенного углеводорода. При межмолекулярной дегидратации продуктами реакции будут простые эфиры и вода.
Рассмотрев химические свойства алкоголей, можно сделать вывод, что одноатомные спирты – это амфотерные соединения, т.к. они могут реагировать с щелочными металлами, проявляя слабые кислотные свойства, и с галогенводородами, проявляя основные свойства. Все химические реакции идут с разрывом связи О-Н или С-О.
Таким образом, предельные одноатомные спирты – это сложные соединения с одной группой ОН, не имеющие свободных валентностей после образования связи С-С и проявляющие слабо свойства и кислот, и оснований. За счет своих физических и химических свойств они нашли широкое применение в органическом синтезе, в производстве растворителей, добавок к топливу, а также в пищевой промышленности, медицине, косметологии (этанол).