Существуют различные виды химической связи. Среди них ковалентная, металлическая, Ван-дер-ваальсова, водородная и ионная. Давайте выясним, что такое ионная связь и ее свойства каковы.
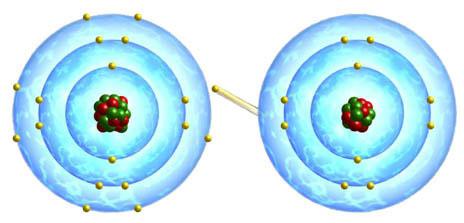
Атом металла без особого труда отдает электрон и становится катионом. А электроотрицательный атом, такой как атом галогена, легко принимает электрон, образуя отрицательно заряженный ион. Эти заряженные частицы – анионы и катионы - и образуют ту, которая имеет название "ионная связь". Примеры ее – это хлорид натрия, бромид калия, иодид лития и другие галоиды металлов (в основном щелочных).
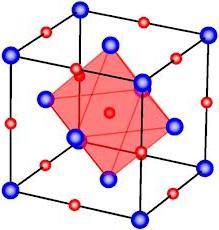
Не имеет свойств направленности и насыщаемости ионная связь. Примеры связей с направленностью и насыщаемостью – ковалентная, донорно-акцепторная связи. Ненасыщаемость и ненаправленность ионной проявляется потому, что при присоединении ионов с другим зарядом не происходит полная компенсация заряда. Могут быть присоединены и другие противоположнозаряженные ионы и так далее. именно поэтому вокруг иона располагается максимально возможное число подобных ему, но с другим знаком. Однако это число ограничено ввиду взаимного отталкивания ионов одинаково заряженных. Равновесие достигается при их определенном взаимном расположении, которое характеризуется координационным числом. Этот показатель зависит от соотношения радиусов ионов. Вещества с ионной связью зачастую имеют координацию куба или октаэдра и представляют собой кристаллы.
Так, кристалл поваренной соли – хлорид натрия - имеет кубическую решетку. В нем каждый ион хлора связан с шестью ионами натрия и каждый ион натрия – с шестью ионами хлора.
В оксидах щелочных и щелочноземельных металлов также наблюдается ионная связь. Примеры таких соединений: оксид кальция, оксид натрия и другие. Ионы могут состоять не только из одного атома, а из нескольких. Внутри такого сложного иона другая, а между самими ионами – ионная связь. Примеры: соли типа сульфата калия (здесь калий – катион, сульфат-ион - анион).
Следует также отметить, что свойства ионов веществ сильно разнятся со свойствами атомов и молекул этих веществ. Так, например, ионы хлора, входящие в состав хлорида натрия, не имеют цвета и запаха и пригодны в пищу, тогда как молекулярный хлор – зеленовато-желтый газ с резким запахом - является ядом. А атомы натрия с водой реагируют со взрывом, ионы же свободно растворяются.





















