Поговорим о том, что представляет собой теплота образования, а также определим те условия, которые называют стандартными. Для того чтобы разобраться в данном вопросе, выясним отличия между простыми и сложными веществами. Чтобы закрепить понятие «теплота образования», рассмотрим конкретные химические уравнения.

Стандартная энтальпия образования веществ
В реакции взаимодействия углерода с газообразным водородом выделяется 76 кДж энергии. В этом случае данная цифра – это тепловой эффект химической реакции. Но это и теплота образования молекулы метана из простых веществ. "Почему?" - спросите вы. Это объясняется тем, что исходными компонентами были углерод и водород. 76 кДж/моль будет той энергией, которая химиками называется "теплота образования".
Таблицы с данными
В термохимии существуют многочисленные таблицы, в которых указаны теплоты образования различных химических веществ из простых веществ. Например, теплота образования вещества, формула которого CO2, в газообразном состоянии имеет показатель 393,5 кДж/моль.
Практическое значение
Зачем нужны данные величины? Теплота образования - это величина, которая применяется при проведении расчета теплового эффекта любого химического процесса. Для того чтобы проводить подобные расчёты, потребуется применение закона термохимии.

Термохимия
Он является основным законом, который объясняет энергетические процессы, наблюдаемые в процессе осуществления химической реакции. Во время взаимодействия наблюдаются качественные преобразования в реагирующей системе. Одни вещества исчезают, вместо них появляются новые компоненты. Такой процесс сопровождается изменением в системе внутренней энергии, проявляется это в виде работы либо теплоты. Работа, которая связана с расширением, для химических превращений имеет минимальный показатель. Теплота, выделяемая при превращении одного компонента в другое вещество, может быть большой величиной.
Если рассматривать разнообразные превращения, практически для всех наблюдается поглощение либо выделение определенного количества тепла. Для объяснения происходящих явлений был создан специальный раздел – термохимия.
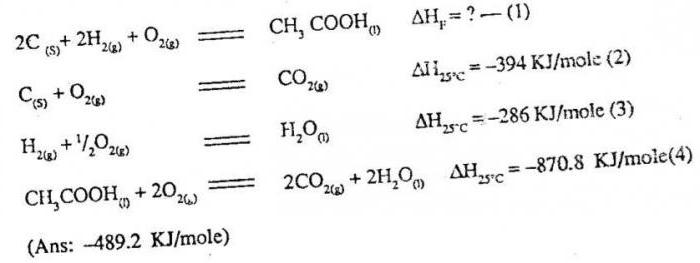
Закон Гесса
Благодаря первому началу термодинамики стало возможным проводить расчет теплового эффекта в зависимости от условий проведения химической реакции. Базируются расчеты на основном законе термохимии, а именно на законе Гесса. Приведем его формулировку: тепловой эффект химического превращения связан с природой, начальным и конечным состоянием вещества, он не связан с путем проведения взаимодействия.
Что следует из данной формулировки? В случае получения определенного продукта нет необходимости применять только один вариант взаимодействия, можно проводить реакцию разнообразными способами. В любом случае, как бы вы ни получали искомое вещество, тепловой эффект процесса будет неизменной величиной. Для его определения нужно суммировать тепловые эффекты всех промежуточных превращений. Благодаря закону Гесса стало возможным выполнение расчетов числовых показателей тепловых эффектов, что невозможно провести в калориметре. К примеру, количественно теплота образования вещества угарного газа вычисляется по закону Гесса, а вот путем обычных опытов определить ее вам не удастся. Именно поэтому так важны специальные термохимические таблицы, в которых внесены цифровые величины для различных веществ, определенные при стандартных условиях
Важные моменты в вычислениях
Учитывая то, что теплота образования - это тепловой эффект реакции, особое значение имеет агрегатное состояние рассматриваемого вещества. Например, при проведении измерений принято считать стандартным состоянием углерода графит, а не алмаз. Также учитывают давление и температуру, то есть те условия, в которых изначально находились реагирующие компоненты. Данные физические величины способны оказывать на взаимодействие существенное влияние, повышают либо понижают величину энергии. Для того чтобы выполнять основные расчеты, в термохимии принято использовать конкретные показатели давления и температуры.
Стандартные условия
Поскольку теплота образования вещества - это определение величины энергетического эффекта именно при стандартных условиях, выделим их отдельно. Температура для расчетов выбирается 298 К (25 градусов по шкале Цельсия), давление – 1 атмосфера. Кроме того, важным моментом, на который стоит обратить внимание, является тот факт, что теплота образования для любых простых веществ равна нулю. Это логично, ведь простые вещества не образуют сами себя, то есть не происходит расходования энергии для их возникновения.
Элементы термохимии
Данный раздел современной химии имеет особое значение, ведь именно здесь проводят важные вычисления, получают конкретные результаты, применяемые в теплоэнергетике. В термохимии существует множество понятий и терминов, которыми важно оперировать, чтобы получать желаемые результаты. Энтальпия (ΔН) свидетельствует о том, что химическое взаимодействие происходило в замкнутой системе, не было влияния на реакцию со стороны других реагентов, постоянным было давление. Такое уточнение позволяет вести речь о точности выполняемых расчетов.
В зависимости от того, какую именно реакцию рассматривают, величина и знак получаемого теплового эффекта могут существенно отличаться. Так, для всех превращений, предполагающих разложение одного сложного вещества на несколько более простых компонентов, предполагается поглощение теплоты. Реакции соединения множества исходных веществ в один, более сложный продукт сопровождаются выделением существенного количества энергии.

Заключение
При решении любой термохимической задачи применяют один и тот же алгоритм действий. Сначала по таблице определяют для каждого исходного компонента, а также для продуктов реакции величину теплоты образования, не забывая об агрегатном состоянии. Далее, вооружившись законом Гесса, составляют уравнение для определения искомой величины.
Особое внимание следует уделять учету стереохимических коэффициентов, имеющихся перед исходными либо конечными веществами в конкретном уравнении. Если в реакции есть простые вещества, то их стандартные теплоты образования равны нулю, то есть такие компоненты не оказывают влияния на получаемый при расчётах результат. Попробуем использовать полученную информацию на конкретной реакции. Если взять в качестве примера процесс образования из оксида железа (Fe3+) чистого металла путем взаимодействия с графитом, то в справочнике можно найти величины стандартной теплоты образования. Для оксида железа (Fe3+) она составит –822,1 кДж/моль, для графита (простого вещества) она равна нулю. В результате реакции образуется угарный газ (CO), для которого данный показатель имеет значение – 110,5 кДж/моль, а для выделяющегося железа теплота образования соответствует нулю. Запись стандартной теплоты образования данного химического взаимодействия характеризуется следующим образом:
ΔНо298 = 3× (–110,5) – (–822,1) = –331,5 + 822,1 = 490,6 кДж.
Анализируя полученный по закону Гесса числовой результат, можно сделать закономерный вывод о том, что данный процесс является эндотермическим превращением, то есть он предполагает затрачивание энергии на реакцию восстановления железа из его трехвалентного оксида.


























