Слово "фермент" имеет латинские корни. В переводе оно означает "закваска". В английском языке применяется понятие "энзим", произошедшее от греческого термина, означающего то же самое. Ферментами называют специализированные белки. Они формируются в клетках и имеют способность ускорять течение биохимических процессов. Другими словами, они выступают в качестве биологических катализаторов. Рассмотрим далее, что собой представляет специфичность действия ферментов. Виды специфичности также будут описаны в статье.
Общая характеристика
Проявление каталитической активности некоторых ферментов обуславливается присутствием ряда соединений небелковой природы. Их именуют кофакторами. Они разделены на 2 группы: ионы металлов и ряд неорганических веществ, а также коферменты (органические соединения).
Механизм активности
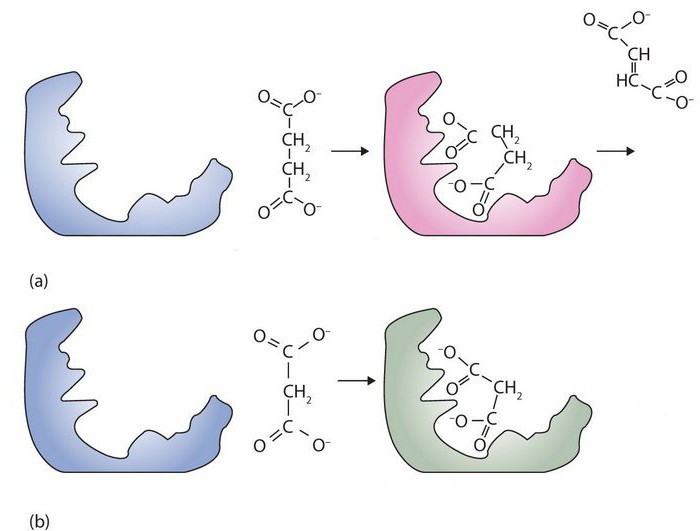
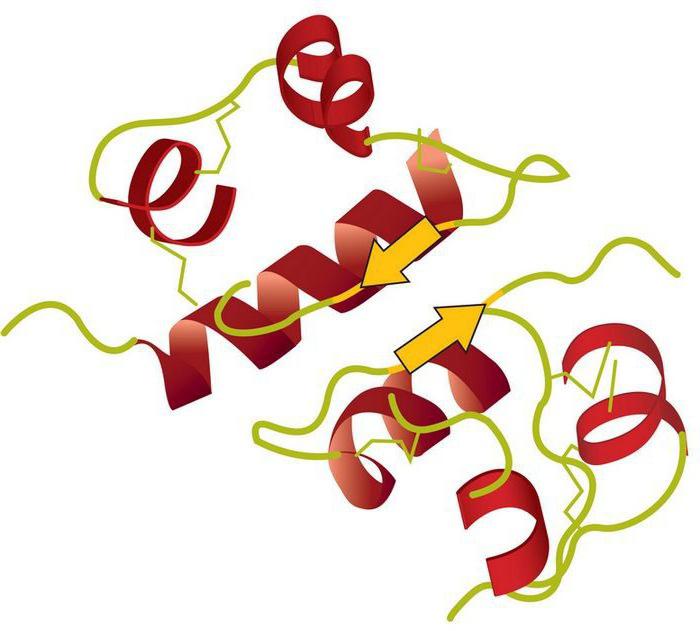
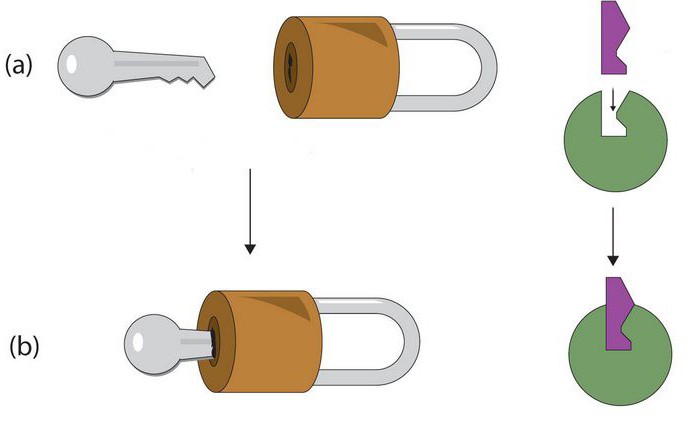
По своей химической природе ферменты относятся к группе белков. Однако, в отличие от последних, рассматриваемые элементы содержат активный центр. Он представляет собой уникальный комплекс функциональных групп остатков аминокислот. Они строго ориентированы в пространстве благодаря третичной либо четвертичной структуре фермента. В активном центре выделяют каталитический и субстратный участки. Последний – это то, чем обусловлена специфичность ферментов. Субстрат представляет собой то вещество, на которое действует белок. Ранее считалось, что их взаимодействие осуществляется по принципу "ключ к замку". Другими словами, активный центр должен четко соответствовать субстрату. В настоящее время господствует иная гипотеза. Считается, что точное соответствие изначально отсутствует, однако оно появляется в ходе взаимодействия веществ. Второй – каталитический – участок влияет на специфичность действия. Другими словами, он определяет характер ускоряемой реакции.
Строение
Все ферменты разделяются на одно- и двухкомпонентные. Первые имеют строение, аналогичное структуре простых белков. Они содержат исключительно аминокислоты. Вторая группа – протеиды – включает в себя белковую и небелковую части. Последней выступает кофермент, первой – апофермент. Последний определяет субстратную специфичность фермента. То есть он выполняет функцию субстратного участка в активном центре. Кофермент, соответственно, выступает как каталитическая область. С ним связана специфичность действия. В качестве коферментов могут выступать витамины, металлы, прочие низкомолекулярные соединения.
Катализ
Возникновение любой химической реакции связано со столкновением молекул взаимодействующих веществ. Их движение в системе определяется наличием потенциальной свободной энергии. Для химической реакции нужно, чтобы молекулы приняли переходное состояние. Другими словами, у них должно быть достаточно силы для прохождения энергетического барьера. Он представляет собой минимальный объем энергии для придания всем молекулам реакционной способности. Все катализаторы, ферменты в том числе, способны снижать энергетический барьер. Это способствует ускоренному течению реакции.
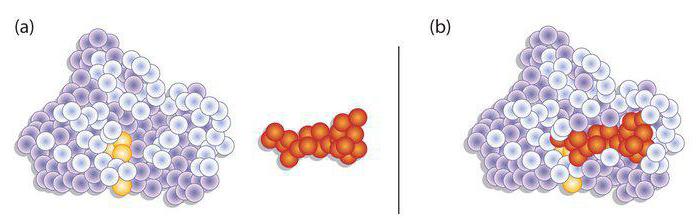
В чем проявляется специфичность ферментов?
Эта способность выражается в ускорении только определенной реакции. Ферменты могут влиять на один и тот же субстрат. Однако каждый из них будет ускорять только конкретную реакцию. Реактивную специфичность фермента можно проследить на примере пируватдегидрогеназного комплекса. В него входят белки, влияющие на ПВК. В качестве основных выступают: пируватдегидрогеназа, пируватдекарбоксилаза, ацетилтрансфераза. Сама реакция именуется окислительным декарбоксилированием ПВК. В качестве ее продукта выступает уксусная активная кислота.
Классификация
Существуют следующие виды специфичности ферментов:
- Стереохимическая. Она выражается в способности вещества влиять на один из возможных субстратных стереоизомеров. К примеру, фумаратгидротаза способна действовать на фумарат. При этом она не влияет на цис-изомер – малеиновую кислоту.
- Абсолютная. Специфичность ферментов этого типа выражается в способности вещества влиять только на конкретный субстрат. К примеру, сахараза реагирует исключительно с сахарозой, аргиназа – с аргинином и так далее.
- Относительная. Специфичность ферментов в этом случае выражена в способности вещества влиять на группу субстратов, имеющих связь одинакового типа. К примеру, альфа-амилаза реагирует с гликогеном и крахмалом. Они имеют связь гликозидного типа. Трипсин, пепсин, химотрипсин влияют на многие белки пептидной группы.
Температура
Ферменты обладают специфичностью в определенных условиях. Для большинства из них в качестве оптимальной принимают температуру +35…+45 град. При помещении вещества в условия с более низкими показателями, активность его будет снижаться. Это состояние именуется обратимой инактивацией. При повышении температуры его способности восстановятся. Стоит сказать, что при помещении в условия, где t будет выше указанных значений, также произойдет инактивация. Однако в этом случае она будет необратимой, поскольку не восстановится при понижении температуры. Это связано с денатурацией молекулы.
Влияние рН
От кислотности зависит заряд молекулы. Соответственно, рН влияет на деятельность активного центра и специфичность фермента. Оптимальный показатель кислотности для каждого вещества свой. Однако в большинстве случаев она составляет 4-7. К примеру, для альфа-амилазы слюны оптимальная кислотность составляет 6.8. Между тем есть и ряд исключений. Оптимальная кислотность пепсина, к примеру, 1.5-2.0, химотрипсина и трипсина – 8-9.
Концентрация
Чем больше будет присутствовать фермента, тем выше скорость реакции. Аналогичный вывод можно сделать и относительно концентрации субстрата. Однако теоретически для каждого вещества определено насыщающее содержание мишени. При ней все активные центры будут заняты имеющимся субстратом. При этом специфичность фермента будет максимальной, вне зависимости от последующего добавления мишеней.
Вещества-регуляторы
Их можно разделить на ингибиторы и активаторы. Обе этих категории разделяются на неспецифические и специфические. К автиваторам последнего типа относят желчнокислые соли (для липазы в поджелужочной железе), хлорные ионы (для альфа-амилазы), соляную кислоту (для пепсина). Неспецифическими активаторами являются ионы магния, влияющие на киназы и фосфатазы, а специфическими ингибиторами – концевые пептиды проферментов. Последние представляют собой неактивные формы веществ. Они активируются при отщеплении концевых пептидов. Их определенные типы соответствуют каждому отдельному проферменту. К примеру, в неактивном виде трипсин вырабатывается в виде трипсиногена. Его активный центр закрывается концевым гексапептидом, который является специфическим ингибитором. В процессе активации происходит его отщепление. Активный центр трипсина в результате этого становится открытым. Неспецифическими ингибиторами являются соли от тяжелых металлов. К примеру, сульфат меди. Они провоцируют денатурацию соединений.
Ингибирование
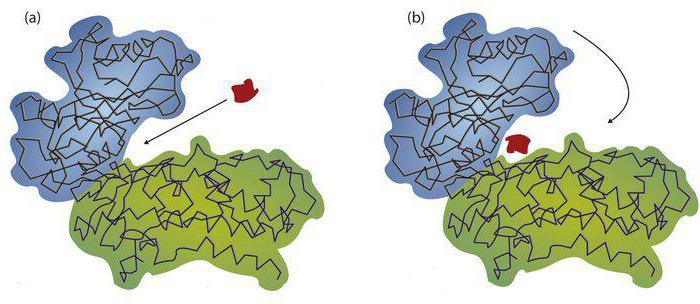
Оно может быть конкурентным. Такое явление выражается в возникновении структурного сходства между ингибитором и субстратом. Они вступают в борьбу за связь с активным центром. Если содержание ингибитора выше, чем субстрата, формируется коплексфермент-ингибитор. При добавлении вещества-мишени соотношение поменяется. В результате ингибитор будет вытеснен. К примеру, сукцинат для сукцинатдегидрогеназы выступает как субстрат. Ингибиторами являются оксалоацетат или малонат. Конкурентными считаются влияния продуктами реакции. Зачастую они похожи на субстраты. К примеру, для глюкозо-6-фосфат продуктом является глюкоза. Субстратом же будет выступать глюкозо-6 фосфат. Неконкурентное ингибирование не предполагает структурного сходства между веществами. Ингибитор и субстрат одновременно могут связываться с ферментом. При этом идет образование нового соединения. Им является комплексфермент-субстрат-ингибитор. В ходе взаимодействия происходит блокирование активного центра. Это обуславливается связыванием ингибитора с каталитическим участком АЦ. Примером может служить цитохромоксидаза. Для этого фермента в качестве субстрата выступает кислород. Ингибиторами цитохромоксидазы являются соли синильной кислоты.
Аллостерическая регуляция
В некоторых случаях, кроме активного центра, определяющего специфичность фермента, присутствует еще одно звено. В качестве него выступает аллостерический компонент. Если с ним связывается одноименный активатор, действенность фермента повышается. Если же в реакцию с аллостерическим центром вступает ингибитор, то активность вещества, соответственно, снижается. К примеру, аденилатциклаза и гуанилатциклаза относятся к ферментам с регуляцией аллостерического типа.


























