Часто перед химиками встает вопрос: как найти молярную массу вещества? С помощью нескольких простых действий это легко сделать самостоятельно. Давайте разберемся с расчетами и научимся вычислять точные значения необходимого показателя.
1. Молярная масса: определение и единицы измерения
Что такое молярная масса? Это физико-химическая характеристика любого вещества, показывающая массу одного моля этого вещества. Моль - это такое количество мельчайших частиц (атомов, молекул, ионов), которое содержит 6,02*1023 структурных единиц. Это число получило название постоянной Авогадро.
Таким образом, молярная масса отражает, сколько граммов вещества приходится на один моль его молекул или атомов. Обозначается латинской буквой M. В Международной системе единиц (СИ) молярная масса измеряется в кг/моль, но традиционно применяют г/моль.
Для расчета используют формулу:
M = m / n
где m - масса вещества в граммах, а n - количество вещества в молях.
Давайте рассчитаем молярную массу воды H2O. Масса 18 г H2O содержит 1 моль молекул. Подставляем значения:
M = 18 г / 1 моль = 18 г/моль
Получили, что молярная масса воды равна 18 г/моль.
2. Как найти молярную массу различных веществ
Методы расчета молярной массы немного различаются для простых веществ, сложных соединений и газов. Давайте последовательно разберем каждый случай.
2.1. Расчет молярной массы простых веществ
Если речь идет о простом веществе, то есть таком, которое состоит из атомов одного химического элемента, то его молярная масса численно равна атомной массе этого элемента.
Например, для расчета молярной массы алюминия заглянем в таблицу Менделеева. Атомная масса алюминия равна 26,98 г/моль. Значит, молярная масса алюминия как простого вещества также будет равна 26,98 г/моль.
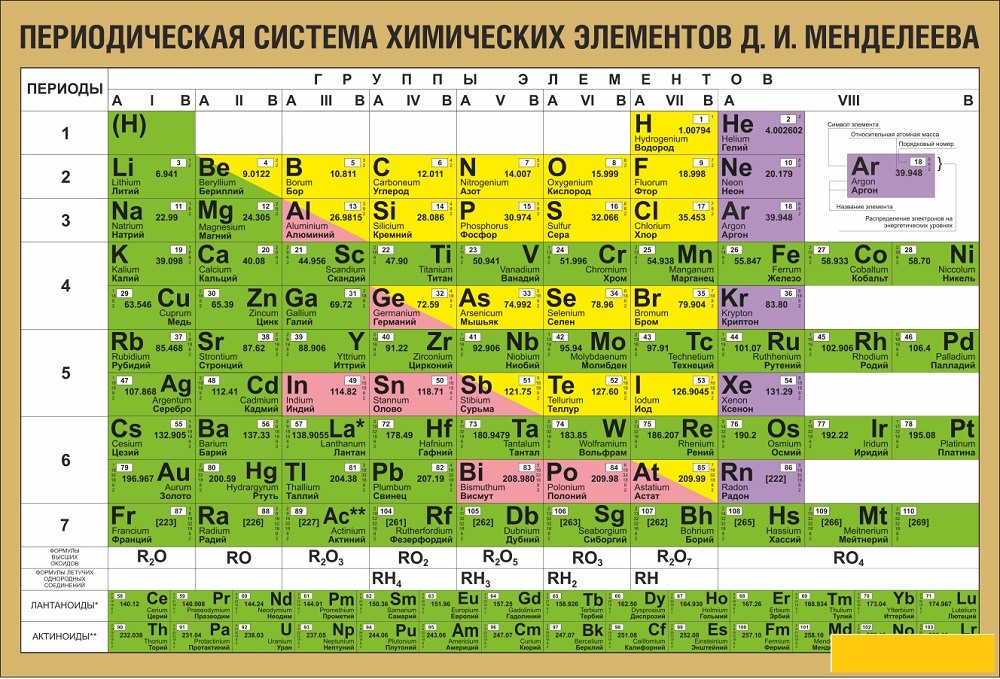
То же самое касается любых других химических элементов в чистом виде. Для определения их молярной массы достаточно найти атомную массу в Периодической системе.
Вот несколько примеров для различных простых веществ:
| Элемент | Атомная масса, г/моль | Молярная масса, г/моль |
| Железо Fe | 55,85 | 55,85 |
| Магний Mg | 24,31 | 24,31 |
| Кислород O | 16 | 16 |
2.2. Определение молярной массы сложных соединений
Гораздо интереснее обстоит дело с определением молярной массы сложных веществ, молекулы которых включают атомы разных химических элементов. Здесь нужно будет учитывать количество каждого типа атомов в молекуле и их атомные массы.
Для этого используется следующая формула:
M = Σn·Ar
Где:
- M - молярная масса сложного вещества
- n - количество атомов каждого элемента в молекуле
- Ar - атомная масса каждого элемента
- Σ - сумма по всем элементам в молекуле
Например, для этилового спирта C2H5OH будем суммировать:
- 2 атома C, Ar(C) = 12
- 6 атомов H, Ar(H) = 1
- 1 атом O, Ar(O) = 16

Подставляем в формулу:
M = 2·12 + 6·1 + 1·16 = 46 г/моль
Таким образом, молярная масса этилового спирта равна 46 г/моль.
Число Авогадро 6,02·1023 молекул в одном моле лежит в основе определения молярной массы любых веществ.
Аналогично можно подсчитать молярную массу для любых других сложных соединений, будь то оксиды, кислоты, основания или соли.
2.3. Расчет для газообразных веществ
В случае газов знание их молярного объема при определенных условиях позволяет также вычислить молярную массу. Согласно закону Авогадро, одинаковые объемы разных газов содержат одно и то же количество молекул.
При нормальных условиях (давление 1 атм, температура 0°С) этот объем составляет 22,4 л на 1 моль газа. То есть, зная объем газа и количество содержащихся в нем молекул, можно определить молярную массу.
Например, 120 л некоторого газа Х содержат 5,36 моль молекул. Тогда молярную массу газа Х можно вычислить как:
M = m / n
120 л / 5,36 моль = 22,4 л/моль
Получаем, что молярная масса газа Х равна 22,4 г/моль - это молярная масса любого идеального газа.





















