В обыденной жизни все мы то и дело сталкиваемся с явлениями, сопровождающими процессы перехода веществ из одного агрегатного состояния в другое. И наиболее часто нам приходится наблюдать подобные явления на примере одного из самых распространенных химических соединений – всем хорошо знакомой и привычной воды. Из статьи вы узнаете, как происходит превращение жидкой воды в твердый лед – процесс, называемый кристаллизацией воды – и какими особенностями характеризуется этот переход.
Что такое фазовый переход?
Всем известно, что в природе существует три основных агрегатных состояния (фазы) вещества: твердое, жидкое и газообразное. Часто к ним добавляют и четвертое состояние – плазму (благодаря особенностям, отличающим ее от газов). Однако при переходе от газа к плазме нет характерной резкой границы, и свойства ее определяются не столько взаимоотношением между частицами вещества (молекулами и атомами), сколько состоянием самих атомов.
Все вещества, переходя из одного состояния в другое, при обычных условиях резко, скачкообразно меняют свои свойства (исключение составляют некоторые сверхкритические состояния, но здесь мы их касаться не будем). Такое превращение и есть фазовый переход, точнее, одна из его разновидностей. Происходит оно при определенном сочетании физических параметров (температуры и давления), называемом точкой фазового перехода.
Превращение жидкости в газ - это испарение, обратное явление – конденсация. Переход вещества из твердого состояния в жидкое – плавление, если же процесс идет в противоположном направлении, то он именуется кристаллизацией. Твердое тело может сразу превратиться в газ и, наоборот – в этих случаях говорят о сублимации и десублимации.
При кристаллизации вода превращается в лед и наглядно демонстрирует, насколько меняются при этом ее физические свойства. Остановимся на некоторых важных подробностях этого явления.

Понятие о кристаллизации
Когда жидкость при охлаждении затвердевает, изменяется характер взаимодействия и расположения частиц вещества. Уменьшается кинетическая энергия беспорядочного теплового движения составляющих его частиц, и они начинают образовывать между собой устойчивые связи. Когда благодаря этим связям молекулы (или атомы) выстраиваются регулярным, упорядоченным образом, формируется кристаллическая структура твердого вещества.
Кристаллизация не охватывает одновременно весь объем охлаждаемой жидкости, а начинается с образования мелких кристалликов. Это так называемые центры кристаллизации. Они разрастаются послойно, ступенчато, путем присоединения все новых молекул или атомов вещества вдоль растущего слоя.
Условия кристаллизации
Кристаллизация требует охлаждения жидкости до некоторой температуры (она же одновременно является и точкой плавления). Так, температура кристаллизации воды при нормальных условиях – 0 °C.
Для каждого вещества кристаллизация характеризуется величиной скрытой теплоты. Это количество энергии, выделяемое при данном процессе (а при обратном – соответственно поглощаемой энергии). Удельная теплота кристаллизации воды – это скрытая теплота, выделяемая одним килограммом воды при 0 °C. Из всех веществ у воды она одна из самых высоких и составляет около 330 кДж/кг. Столь большая величина обусловлена особенностями структуры, определяющими параметры кристаллизации воды. Формулой для расчета скрытой теплоты мы воспользуемся ниже, после рассмотрения этих особенностей.
Для компенсации скрытой теплоты необходимо переохладить жидкость, чтобы начался рост кристаллов. Степень переохлаждения оказывает существенное влияние на количество центров кристаллизации и на скорость их разрастания. Пока протекает процесс, дальнейшее охлаждение температуры вещества не меняет.
Молекула воды
Чтобы полнее представлять себе, каким образом происходит кристаллизация воды, необходимо знать, как устроена молекула этого химического соединения, ведь строение молекулы обусловливает особенности связей, которые она образует.
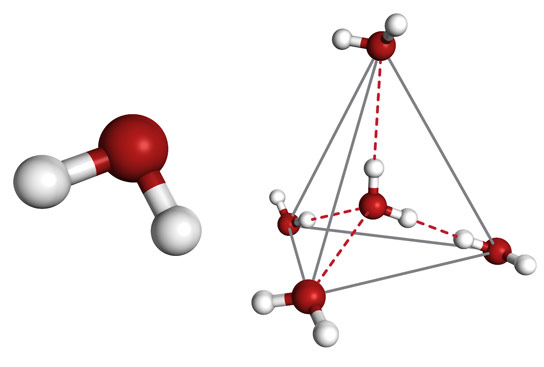
В молекуле воды объединены один атом кислорода и два атома водорода. Они формируют тупоугольный равнобедренный треугольник, в котором атом кислорода расположен в вершине тупого угла величиной 104,45°. При этом кислород сильно оттягивает электронные облака в свою сторону, так что молекула представляет собой электрический диполь. Заряды в нем распределены по вершинам воображаемой четырехгранной пирамиды – тетраэдра с внутренними углами приблизительно 109°. Вследствие этого молекула может образовывать по четыре водородных (протонных) связи, что, разумеется, влияет на свойства воды.
Особенности структуры жидкой воды и льда
Способность молекулы воды к формированию протонных связей проявляется и в жидком, и в твердом состоянии. Когда вода – жидкость, связи эти достаточно неустойчивы, легко разрушаются, но и постоянно образуются снова. Благодаря их наличию молекулы воды связаны между собой сильнее, чем частицы других жидкостей. Ассоциируясь, они формируют особые структуры – кластеры. По этой причине фазовые точки воды смещены в сторону более высоких температур, ведь для разрушения таких дополнительных ассоциатов тоже нужна энергия. Причем энергия довольно значительная: не будь водородных связей и кластеров, температура кристаллизации воды (а также ее плавления) составила бы –100 °C, а кипения +80 °C.
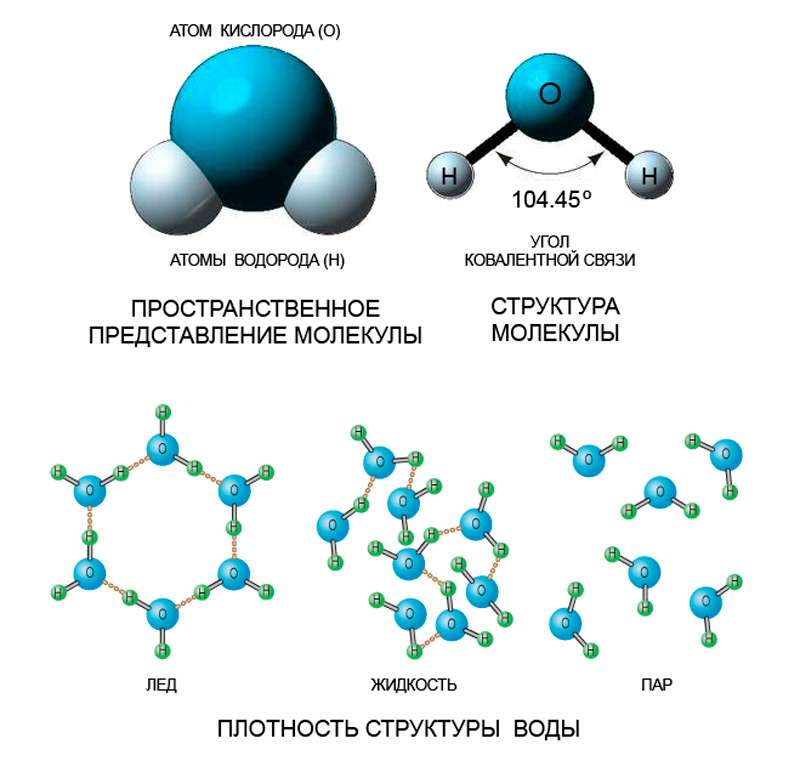
Строение кластеров идентично строению кристаллического льда. Связываясь каждая с четырьмя соседками, молекулы воды выстраивают ажурную кристаллическую структуру с основой в форме шестиугольника. В отличие от жидкой воды, где микрокристаллы – кластеры – непостоянны и подвижны из-за теплового движения молекул, при образовании льда они перестраиваются устойчивым и регулярным образом. Водородные связи фиксируют взаимное расположение узлов кристаллической решетки, и в результате расстояние между молекулами становится несколько больше, чем в жидкой фазе. Этим обстоятельством объясняется скачок плотности воды при ее кристаллизации – плотность падает с почти 1 г/см3 до примерно 0,92 г/см3.
О скрытой теплоте
Особенности молекулярного строения воды весьма серьезно отражаются на ее свойствах. Это видно, в частности, по большой удельной теплоте кристаллизации воды. Она обусловлена именно наличием протонных связей, отличающим воду от прочих соединений, образующих молекулярные кристаллы. Установлено, что энергия водородной связи в воде составляет около 20 кДж на моль, то есть на 18 г. Значительная часть этих связей устанавливается «в массовом порядке» при замерзании воды – вот откуда берется такая большая отдача энергии.
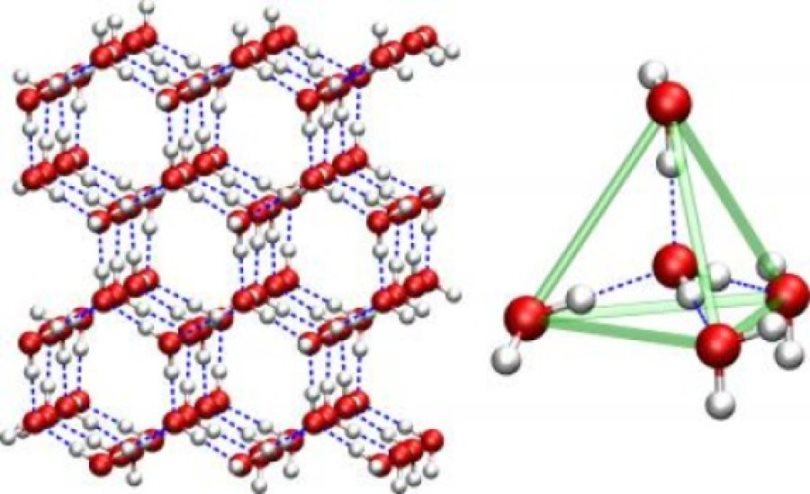
Приведем несложный расчет. Пусть при кристаллизации воды выделилось 1650 кДж энергии. Это немало: эквивалентную энергию можно получить, например, при взрыве шести гранат-лимонок Ф-1. Подсчитаем массу подвергшейся кристаллизации воды. Формула, связывающая количество скрытой теплоты Q, массу m и удельную теплоту кристаллизации λ, очень проста: Q = – λ * m. Знак минуса означает просто, что тепло отдается физической системой. Подставляя известные величины, получим: m = 1650/330 = 5 (кг). Всего 5 литров нужно, чтобы целых 1650 кДж энергии выделилось при кристаллизации воды! Разумеется, энергия отдается не мгновенно – процесс длится в течение достаточно продолжительного времени, и теплота рассеивается.
Об этом свойстве воды прекрасно знают, например, многие птицы, и используют его, чтобы погреться возле замерзающей воды озер и рек, в таких местах температура воздуха на несколько градусов выше.
Кристаллизация растворов
Вода – замечательный растворитель. Вещества, растворенные в ней, сдвигают точку кристаллизации, как правило, в сторону понижения. Чем выше концентрация раствора, тем при более низкой температуре будет происходить замерзание. Ярким примером служит морская вода, в которой растворено много различных солей. Их концентрация в воде океанов составляет 35 промилле, и кристаллизуется такая вода при –1,9 °C. Соленость воды в разных морях сильно отличается, поэтому и точка замерзания бывает различной. Так, вода Балтики имеет соленость не более 8 промилле, и температура кристаллизации ее близка к 0 °C. Минерализованные грунтовые воды также замерзают при температурах ниже нуля. Следует иметь в виду, что речь всегда идет только о кристаллизации воды: морской лед практически всегда пресный, в крайнем случае слабосоленый.

Водные растворы различных спиртов тоже отличаются пониженной температурой замерзания, причем кристаллизация их протекает не скачкообразно, а с некоторым интервалом температур. Например, 40-процентный спирт начинает замерзать при -22,5 °C, а окончательно кристаллизуется при -29,5 °C.
А вот раствор такой щелочи, как едкий натр NaOH или каустик являет собой интересное исключение: ему свойственна повышенная температура кристаллизации.
Как замерзает чистая вода?
В дистиллированной воде кластерная структура нарушена вследствие испарения при дистилляции, и количество водородных связей между молекулами такой воды очень мало. Кроме того, в такой воде отсутствуют примеси типа взвешенных микроскопических пылинок, пузырьков и т. п., представляющих собой дополнительные центры кристаллообразования. По этой причине точка кристаллизации дистиллированной воды понижена до –42 °C.
Можно переохладить дистиллированную воду даже до –70 °C. В подобном состоянии переохлажденная вода способна кристаллизоваться практически мгновенно по всему объему при малейшем сотрясении или попадании ничтожной примеси.

Парадоксальная горячая вода
Удивительный факт – горячая вода переходит в кристаллическое состояние быстрее, чем холодная – получил название «эффекта Мпембы» в честь танзанийского школьника, обнаружившего этот парадокс. Точнее, знали о нем еще в древности, однако, не найдя объяснения, натурфилософы и естествоиспытатели в конце концов перестали обращать внимание на загадочный феномен.
В 1963 году Эрасто Мпемба был удивлен тем, что подогретая смесь для мороженого застывает быстрее, чем холодная. А в 1969 году интригующее явление получило подтверждение уже в физическом эксперименте (кстати, с участием самого Мпембы). Эффект объясняют целым комплексом причин:
- большее количество центров кристаллизации, таких как воздушные пузырьки;
- высокая теплоотдача горячей воды;
- высокий темп испарения, влекущего за собой уменьшение объема жидкости.
Давление как фактор кристаллизации
Взаимосвязь давления и температуры как ключевых величин, влияющих на процесс кристаллизации воды, наглядно отражена на фазовой диаграмме. Из нее видно, что при повышении давления температура фазового перехода воды из жидкого в твердое состояние чрезвычайно медленно понижается. Естественно, справедливо и обратное: чем давление ниже, тем более высокая температура нужна для образования льда, и растет она точно так же медленно. Чтобы добиться условий, при которых вода (не дистиллированная!) способна кристаллизоваться в обычный лед Ih при минимально возможной температуре –22 °C, давление нужно увеличить до 2085 атмосфер.
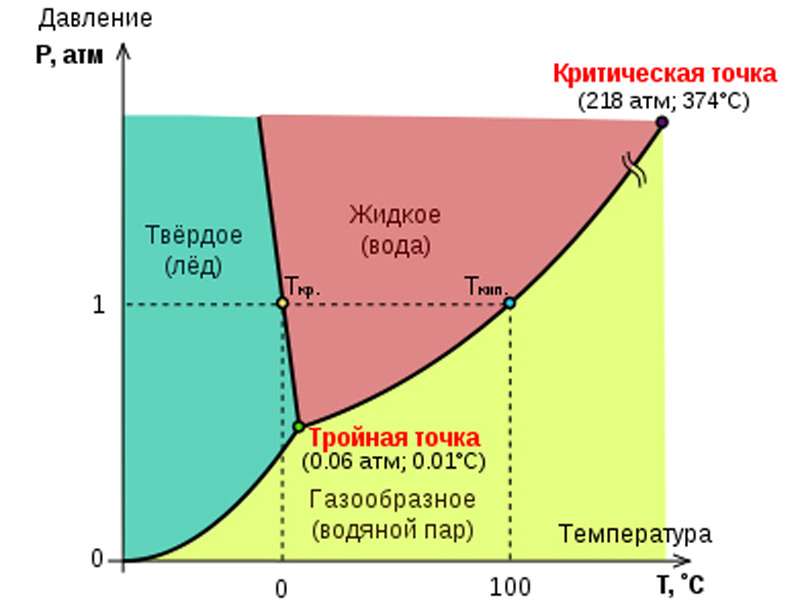
Максимальная температура кристаллизации соответствует следующему сочетанию условий, называемому тройной точкой воды: 0,006 атмосфер и 0,01 °C. При таких параметрах точки кристаллизации-плавления и конденсации-кипения совпадают, и все три агрегатных состояния воды сосуществуют равновесно (в отсутствие других веществ).
Множество типов льда
В настоящее время известно около 20 модификаций твердотельного состояния воды – от аморфного до льда XVII. Все они, кроме обычного льда Ih, требуют экзотических для Земли условий кристаллизации, и далеко не все стабильны. Только лед Ic очень редко обнаруживается в верхних слоях земной атмосферы, но его формирование связано не с замерзанием воды, так как он образуется из водяных паров при чрезвычайно низких температурах. В Антарктиде был найден лед XI, однако эта модификация – производная обычного льда.
Путем кристаллизации воды при экстремально высоких давлениях можно получить такие модификации льда, как III, V, VI, и с одновременным повышением температуры – лед VII. Вполне вероятно, что какие-либо из них могут образовываться в условиях, необычных для нашей планеты, на других телах Солнечной системы: на Уране, Нептуне или крупных спутниках планет-гигантов. Надо думать, будущие эксперименты и теоретические исследования малоизученных пока свойств этих льдов, а также особенности процессов их кристаллизации, прояснят этот вопрос и откроют еще много нового.