Изучение процессов, протекающих в статистических системах, усложнено минимальным размером частиц и огромным их количеством. Рассмотреть отдельно каждую частицу практически невозможно, поэтому вводятся статистические величины: средняя скорость частиц, их концентрация, масса частицы. Формула, характеризующая состояние системы с учетом микроскопических параметров, называется основным уравнением молекулярно-кинетической теории газов (МКТ).
Немного о средней скорости движения частиц
Определение скорости движения частиц впервые было проведено экспериментально. Известный из школьной программы опыт, проведенный Отто Штерном, позволил создать представление о скоростях частиц. В ходе эксперимента исследовалось движение атомов серебра во вращающихся цилиндрах: сначала в неподвижном состоянии установки, затем при вращении ее с некоторой угловой скоростью.
В итоге было установлено, что скорость молекул серебра превышает величину скорости звука и составляет 500 м/с. Факт достаточно интересен, поскольку такие скорости движения частиц в веществах человеку ощутить трудно.
Идеальный газ
Продолжить исследование представляется возможным только в системе, параметры которой определить непосредственными измерениями можно с использованием физических приборов. Скорость измеряют спидометром, но идея прикрепить спидометр к отдельной частице абсурдна. Непосредственно измерить можно только макроскопический параметр, связанный с движением частиц.
Любая система взаимодействующих тел характеризуется потенциальной энергией и кинетической энергией движения. Реальный газ – система сложная. Изменчивость потенциальной энергии не поддается систематизации. Решить проблему можно, введя модель, несущую характерные свойства газа, отметающую сложность взаимодействия.
Идеальный газ – состояние вещества, при котором взаимодействие частиц пренебрежимо мало, потенциальная энергия взаимодействия стремится к нулю. Значимой можно считать только энергию движения, зависящую от скорости частиц.
Давление идеального газа
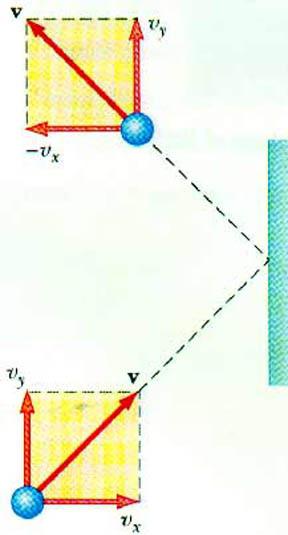
Выявить связь между давлением газа и скоростью движения его частиц позволяет основное уравнение МКТ идеального газа. Частица, движущаяся в сосуде, при соударении со стенкой передает ей импульс, величину которого можно определить на основании II закона Ньютона:
- F∆t = 2m0vx
Изменение импульса частицы при упругом ударе связано с изменением горизонтальной составляющей ее скорости. F – сила, действующая со стороны частицы на стенку в течение краткого времени t; m0 – масса частицы.
С поверхностью площадью S в течение времени ∆t сталкиваются все частицы газа, движущиеся в направлении поверхности со скоростью vx и расположенные в цилиндре объемом SυxΔt. При концентрации частиц n ровно половина молекул движется к стенке, вторая половина – в обратном направлении.
Рассмотрев соударение всех частиц, можно записать закон Ньютона для силы, действующей на площадку:
- F∆t = nm0vx2S∆t
Поскольку давление газа определяется как отношение силы, действующей перпендикулярно поверхности, к площади последней, можно записать:
- p = F : S = nm0vx2
Полученное соотношение как основное уравнение МКТ не может описать всю систему, т. к. рассмотрено движение только в одном направлении.
Распределение Максвелла
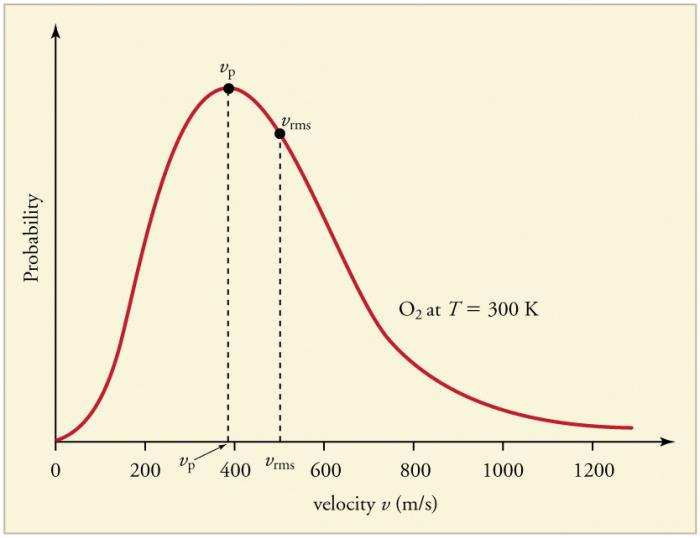
Непрекращающиеся частые соударения частиц газа со стенками и друг с другом приводят к установлению определенного статистического распределения частиц по скоростям (энергиям). Направления всех векторов скоростей оказываются равновероятными. Такое распределение получило название распределение Максвелла. В 1860 году эта закономерность была выведена Дж. Максвеллом на основании МКТ. Основными параметрами закона распределения называют скорости: вероятную, соответствующую максимальному значению кривой, и среднеквадратичную vкв = √‹v2› - среднее квадрата скорости частиц.
Увеличение температуры газа соответствует возрастанию значения скоростей.
Исходя из того, что все скорости равноправны, а их модули имеют одинаковое значение, можно считать:
- ‹v2› = ‹vx2› + ‹vy2› + ‹vz2›, откуда: ‹vx2› = ‹v2› : 3
Основное уравнение МКТ с учетом усредненного значения давления газа имеет вид:
- p = nm0‹v2› : 3.
Это соотношение уникально тем, что определяет связь между микроскопическими параметрами: скоростью, массой частицы, концентрацией частиц и давлением газа в целом.
Используя понятие кинетической энергии частиц, основное уравнение МКТ можно переписать иначе:
- p = 2nm0‹v2› : 6 = 2n‹Eк› : 3
Давление газа пропорционально среднему значению кинетической энергии его частиц.
Температура
Интересно, что для неизменного количества газа в закрытом сосуде можно связать давление газа и среднее значение энергии движения частиц. Измерение давления при этом можно производить, измеряя энергию частиц.
Как поступить? Какую величину можно сопоставить с кинетической энергией? Такой величиной оказывается температура.


Универсальная шкала температур
Более интересными с точки зрения независимости от свойств рабочего тела можно считать газовые термометры. Их шкала не зависит от рода используемого газа. В таком приборе можно гипотетически выделить температуру, при которой стремится к нулю давление газа. Вычисления показывают, что эта величина соответствует -273,15 оС. Температурная шкала (абсолютная шкала температур или шкала Кельвина) была введена в 1848 году. За основную точку этой шкалы приняли возможную температуру нулевого давления газа. Единичный отрезок шкалы равен единичному значению шкалы Цельсия. Записать основное уравнение МКТ с использованием температуры представляется более удобным при исследовании газовых процессов.
Связь давления и температуры
Опытным путем можно убедиться в пропорциональности давления газа его температуре. Одновременно выяснено, что давление прямо пропорционально концентрации частиц:
- P = nkT,
где Т – абсолютная температура, k-постоянная величина, равная 1.38•10-23Дж/К.
Фундаментальную величину, имеющую неизменное значение для всех газов, называют постоянной Больцмана.
Сравнивая зависимость давления от температуры и основное уравнение МКТ газов, можно записать:
- ‹Eк› = 3kT : 2
Среднее значение кинетической энергии движения молекул газа пропорционально его температуре. То есть температура может служить мерой кинетической энергии движения частиц.


























